
下列选用的相关仪器、用品不符合实验要求的是( )
| A | B | C | D |
| 准确量取19.01 mL水 | 新制氯 | 测定0.1 mol/L Na2CO3溶液的pH |
|
| 25 mL酸式滴定管 | 带玻璃塞的棕色细口瓶 | 镊子、pH试纸、表面皿 | 分液漏斗、烧杯 |
科目:高中化学 来源: 题型:
X、Y、Z分别是三种单质,它们都是常见的金属或非金属.M、N、R是常见的三种氧化物.其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平):
⑴X + Z → N;⑵M+X → N;⑶ M+Y→ R+X 。若X是非金属,则组成Y单质的元素在周期表中的位置是
A.第二周期ⅣA族 B.第二周期ⅥA族
C.第三周期ⅡA族 D.第三周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A.容器内的总压不随时间变化
B.单位时间生成nmol的A2同时生成2nmol的AB
C.单位时间生成2nmol的AB同时消耗nmol的B2
D.单位时间生成nmol的A2同时生成nmol的B2
查看答案和解析>>
科目:高中化学 来源: 题型:
高温条件下反应达到平衡时的平衡常数 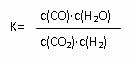 。恒容条件下升高温度,H2浓度减小。则下列说法正确的是
。恒容条件下升高温度,H2浓度减小。则下列说法正确的是
A.反应的热化学方程式可表示为:CO(g)+H2O(g) CO2(g)+H2(g) △H<0 kJ/mol
CO2(g)+H2(g) △H<0 kJ/mol
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小 D.该反应的正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氨的合成是重要的一项化工生产。已知合成氨有关能量变化的图像如图 1。
1。
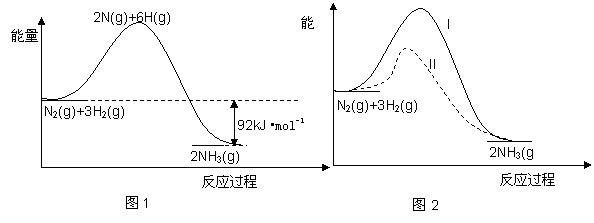
(1)反应 N2(g)+3H2(g) 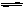 2NH3(g) △H= ;
2NH3(g) △H= ;
(2)化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。现提供以下化学键的键能(kJ·mol-1):H—H:436,N≡N:946,则N—H的键能是 kJ·mol-1;
mol化学键时释放(或吸收)的能量。现提供以下化学键的键能(kJ·mol-1):H—H:436,N≡N:946,则N—H的键能是 kJ·mol-1;
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是 ;
(4)在一个密闭容器中加入1molN2、3mol H2,一定条件下充分反应,其热效应始终小于92 kJ,请说明原因 ;
(5)在一个密闭容器中加入amolN2、bmol H2,达到平衡时n(N2):n(H2)=1:3,则a:b= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的的是( )
| 选项 | A | B | C | D |
| 实验 目的 | 除去KCl中少量MnO2 | 用10 mol·L-1盐酸配制100 mL 0.1 mol·L-1盐酸 | 用NaCl溶 液制备氯 化钠晶体 | 除去乙烯中少量SO2 |
| 实验仪器或装置 | 烧杯、玻璃 棒、分液漏斗 | 100 mL容量瓶、玻璃棒、烧杯 |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
A.Mg Mg(NO3)2
Mg(NO3)2
B.Mg MgCl2
MgCl2 Mg(OH)2
Mg(OH)2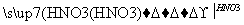 Mg(NO3)2
Mg(NO3)2
C.Mg MgO
MgO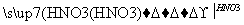 Mg(NO3)2
Mg(NO3)2
D.Mg MgSO4
MgSO4 Mg(NO3)2
Mg(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
分别用双线桥法和单线桥法分析下列氧化还原反应中化合价的变化,标出电子转移的方向和数目。
(1)2KNO3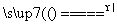 2KNO2+O2↑
2KNO2+O2↑
(2)Fe+H2SO4===FeSO4+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com