
| A. | 纤维素的水解难于淀粉的水解 | |
| B. | 碘化钾溶液能使淀粉变蓝 | |
| C. | 多糖一般没有还原性,不能发生银镜反应 | |
| D. | 用淀粉制酒精仅发生了水解反应 |
分析 A.原因在于(1)大多数纤维素处于结晶态而难于水解;(2)在纤维素中葡萄糖单体是以β-1,4苷键联结的,它比淀粉中的α-1,4苷键更难水解;(3)纤维素还与半纤维素、木质素相联结;
B.淀粉遇碘变蓝,KI溶液中不存在碘单质;
C.含有醛基的糖类能发生银镜反应,据此解答即可;
D.淀粉水解可以制得单糖,葡萄糖不能水解,据此解答即可.
解答 解:A.由分析可知:纤维素的水解难于淀粉的水解,故A正确;
B.KI淀粉试纸中不含有碘单质,不能使淀粉变蓝,故B错误;
C.含有醛基的有机物能发生银镜反应,多糖一般不含有醛基,不能发生银镜反应,故C正确;
D.用淀粉制取酒精是多糖水解为单糖,然后单糖在酒化酶的作用下产生酒精不是水解反应,故D错误,
故选BD.
点评 本题主要考查的是淀粉纤维素的性质以及比较,容易出错的是选项A,本题有一定的难度.


科目:高中化学 来源: 题型:选择题
| A. | 8 | B. | 10 | C. | 12 | D. | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
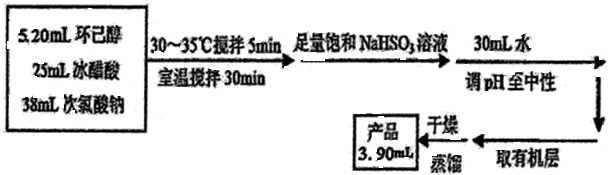
 环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为:
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为: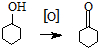
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 某溶液中加入氯化钡溶液,产生白色沉淀,再加入稀硝酸沉淀不溶解 | 溶液中一定含有SO42- |
| B | 某溶液中加入硝酸银溶液,产生白色沉淀 | 溶液中一定含有Cl- |
| C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无K+ |
| D | 向某溶液中先加几滴KSCN溶液,无明显现象,再滴氯水,溶液变红 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能Y小于X | |
| B. | 最高价含氧酸的酸性:X对应的酸的酸性强于Y | |
| C. | 气态氢化物的稳定性:HmY强于HnX | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | Cl2+H2O═HCl+HClO | ||
| C. | 2H2O═2H2↑+O2↑ | D. | Na2O+H2O═2NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com