
| A. | 16mL | B. | 20mL | C. | 32mL | D. | 40mL |
分析 300mL某浓度的NaOH溶液中含有60g溶质,n(NaOH)=$\frac{60g}{40g/mol}$=1.5mol,c=$\frac{1.5mol}{0.3L}$=5mol/L,浓溶液配制稀溶液时,溶质的物质的量不变,以此来解答.
解答 解:300mL某浓度的NaOH溶液中含有60g溶质,n(NaOH)=$\frac{60g}{40g/mol}$=1.5mol,c=$\frac{1.5mol}{0.3L}$=5mol/L,
由配制前后溶质的物质的量不变可知,
配制80mLmol/LNaOH溶液,选择100mL容量瓶,则应取该溶液的体积为$\frac{0.1L×1mol/L}{5mol/L}$=0.02L=20mL,
故选B.
点评 本题考查配制一定浓度的溶液,为高频考点,把握物质的量与浓度的关系,容量瓶的选择为解答的关键,侧重分析与计算能力的考查,注意容量瓶的选择为易错点,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
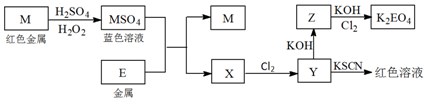
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 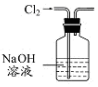 用图所示装置除去Cl2中含有的少量HCl | |
| B. |  用图所示装置蒸干NaHCO3溶液制备NaHCO3晶体 | |
| C. | 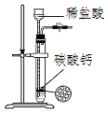 用图所示装置制取少量纯净的CO2气体 | |
| D. | 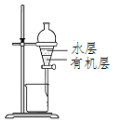 用图所示装置分离CCl4萃取碘水后的液态混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
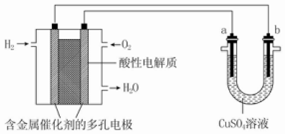
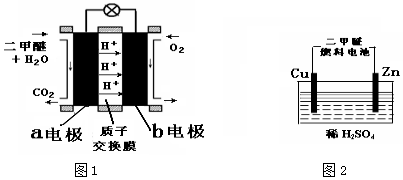
| A. | 燃料电池工作时,正极反应为 O2+2H2O+4e═4OH | |
| B. | a 极是铁,b 极是铜时,b 极逐渐溶解,a 极上有铜析出 | |
| C. | a 极是粗铜,b 极是纯铜时,a 极逐渐溶解,b 极上有铜析出 | |
| D. | a、b 两极均是石墨时,在相同条件下 a 极产生的气体与电池中消耗的 H2 体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com