
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
分析 ①令平衡时参加反应的CO为xmol,表示出平衡时各组分的物质的量,根据平衡常数列方程计算x,转化率=$\frac{物质的转化量}{物质的起始量}$;
②a.反应前后气体质量变化,体积不变,随反应进行气体密度发生变化,若容器内气体密度恒定时,标志反应达到平衡状态;
b.反应前后有气体参与,恒温恒容下,反应前后气体体积改变,压强恒定时,标志反应到达平衡状态;
c.甲为等效平衡,平衡时CO的含量相等,CO的含量=$\frac{c(CO)_{平衡}}{c(混合)_{总}}$;
d.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率.
解答 解:①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳浓度为x
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol.L) 0.5 0.5
变化量(mol/L) x x
平衡量(mol/L) 0.5-x 0.5+x
化学平衡常数k=$\frac{c^3(C{O}_{2})}{c^3(CO)}$=$\frac{(0.5+x)^3}{(0.5-x)^3}$=64,计算得到x=0.6,所以转化率为60%;
故答案为:60%;
②a.ρ=$\frac{m}{V}$,反应前后气体质量变化,体积不变,随反应进行气体密度发生变化,若容器内气体密度恒定时,标志反应达到平衡状态,故a正确;
b.若容器压强始终恒定,不能标志反应达到平衡状态,故b错误;
c.甲为等效平衡,平衡时CO的含量相等,由于CO的含量=$\frac{c(CO)_{平衡}}{c(混合)_{总}}$,则平衡时甲、乙中CO的平衡浓度之比为2mo/L:3mol/L=2:3,故c正确;
d.Fe2O3为固体量,增加其用量,不影响化学平衡移动,不能提高CO的转化率,故d错误.
故答案为:ac.
点评 本题考查了平衡常数计算应用,化学平衡三段式列式计算方法题目,难度中等,注意固体不影响化学平衡,易错.


科目:高中化学 来源: 题型:实验题

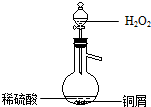 (3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.
(3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| U | |||
| W | Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:8 | B. | 8:1 | C. | 2:5 | D. | 5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

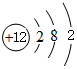 ,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C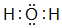 ,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.
,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 两者的分散质微粒均能透过半透膜和滤纸 | |
| C. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的“光亮的通路”,前者则没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体、BaSO4 | B. | 铜、二氧化硫 | C. | 硫酸溶液、HCl | D. | 熔融的KNO3、酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com