
右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是( )
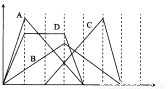
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
科目:高中化学 来源:2015-2016学年吉林省高二上学期期中(理)化学试卷(解析版) 题型:选择题
一定条件下的密闭容器中,进行如下反应:NO(g)+CO(g)  1/2N2(g)+CO2(g) ΔH=-373.2 kJ/mol,为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是
1/2N2(g)+CO2(g) ΔH=-373.2 kJ/mol,为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是
A.加(正)催化剂 B.增大压强(体积减小)
C.给体系加热 D.从体系中不断移去部分CO2
查看答案和解析>>
科目:高中化学 来源:2016届浙江省富阳市高三上学期第二次质检化学试卷(解析版) 题型:填空题
某结晶水合物A含有两种阳离子和一种阴离子。将溶有90.60gA的水溶液分成两等份,向第一份逐滴加入NaOH溶液,溶液先出现白色沉淀后完全溶解,此过程中产生2.24 L(标准状况)刺激性气味的气体。向第二份加入过量的Ba(OH)2溶液,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.60 g。
请回答以下问题:
(1)A的摩尔质量为 。
(2)试通过计算确定该结晶水合物的化学式为 。
(3)若第二份加入75.00 mL2.00 mol·L-1的Ba(OH)2溶液,则得到的沉淀质量为 。
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三11月月考理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是
A.Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2
B.用CO2可以鉴别NaAlO2溶液和CH3COONa溶液
C.稀豆浆、硅酸、氯化铁溶液均为胶体
D.用BaCl2可以溶液鉴别AgNO3溶液和K2SO4溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高一上学期期中考试化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A.纯净物一定由分子 构成
构成
B.由同种分子构成的物质一定是纯净物
C.混合物肯定是由两种以上的元素组成的
D.含有氧元素的化合物就是氧化物
查看答案和解析>>
科目:高中化学 来源:2016届四川省成都市高三上学期期中考试化学试卷(解析版) 题型:填空题
T1温度下,体积为 2L的恒容密闭容器,加入4.00molX,2.00molY,发生化学反应 2X(g)+Y(g) 3M(g)+N(s) △H<0。
3M(g)+N(s) △H<0。
部分实验数据如表格所示。
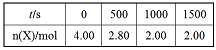
(1)前500s反应速率v(M)=_____,该反应的平衡常数K=_____。
(2)若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____(填序号)
a.X的消耗速率与M的消耗速率相等 b.混合气体的平均相对分子质量不变
c.v(Y)与v(M)的比值不变 d.固体的总质量不变
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____。
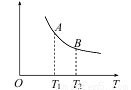
a.Y的逆反应速率
b.M的体积分数
c.混合气体的平均相对分子质量
d.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____。
A.平衡不移动
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡不相等
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____1.5mol/L(填“>”、“=”或“<”),理由是_____。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上学期期中测试化学试卷(解析版) 题型:填空题
Ⅰ.用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
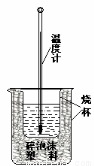
(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和_ 。泡沫塑料的作用是 。
(2)若稀盐酸用相同体积的下列溶液代替,则对中和热数值测定结果将如何影响(填“偏大”、“偏小”、“无影响”):浓硫酸 ;稀硝酸 ;醋酸溶液 。
Ⅱ.如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管
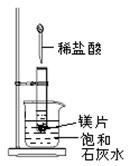
(1)写出有关的离子方程式:______________________ 。
(2)烧杯中出现的现象为: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上学期期中测试化学试卷(解析版) 题型:选择题
质量相同的N2和CO,下列物理量不一定相同的是
A.物质的量 B.分子个数 C.原子个数 D.气体体积
查看答案和解析>>
科目:高中化学 来源:2016届湖南省澧县、桃源、益阳三校高三上学期联考化学试卷(解析版) 题型:填空题
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)锡元素在周期表中位于第五周期,与碳元素位于同一主族,则锡元素的原子的核电荷数为_______。
(2)操作Ⅰ是_________、冷却结晶________、洗涤、干燥。。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因___________________________。
(4)加入Sn粉的作用有两个:①调节溶液pH,②__________________________。
(5)酸性条件下,SnSO4还可以作双氧水去除剂,发生反应的离子方程式是___________。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.19g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com