
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有4个电子。
(1)D原子的电子排布式为 ,若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键。
(2)当n=2时,B的原子结构示意图为 ,B与C形成的晶体属于 晶体。
当n=3时,B与C形成的晶体属于 晶体。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是 ,A、B、C、D四种元素的电负性由大到小的顺序是 (用元素符号表示)。
(4)C和D的最简单氢化物相比较:稳定性: (填化学式,下同);
沸点: 原因是 。
(19分)
(1)1s22s22p63s23p4, σ
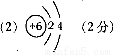 , 分子, 原子
, 分子, 原子
(3)第2周期I A族, O>S>Si>Li
(4)H20>H2S H20>H2S 水分子间存在氢键
【解析】
试题分析:短周期元素中,A元素原子的最外层电子排布为ns1,为ⅠA族元素;B元素原子的价电子排布为ns2np2,为ⅣA族;C元素原子的最外层电子数是其电子层数的3倍,为O元素;D元素原子的M电子层的P轨道中有4个电子,为S元素。
(1)根据上述分析,D为P元素,则P原子电子排布式为:1s22s22p63s23p4;C为O,价电子数为6,价电子排布为2s22p4;A元素的原子最外层电子排布为1s1,为H元素,与O形成共价单键,按照重叠方式,属于δ键。
(2)当n=2时,B为C元素,C原子结构示意图为: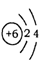 ;B与C形成的二氧化碳晶体,为分子
;B与C形成的二氧化碳晶体,为分子
晶体;当n=3时,B的价电子排布为3s23p2,为Si元素,B与C形成二氧化硅晶体,属于原子晶体。
(3)若A元素原子的最外层电子排布为2s1,为Li元素,位于周期表中第2周期第IA族;B元素的原子价电子排布为3s23p2,为Si,C为O,D为S,非金属性越强,第一电离能越大,则第一电离能为O>S>Si>Li。
(4)C和D的最简单氢化物分别为H2O、H2S,因为O元素的非金属性大于S,所以稳定性:H20>H2S;H2O分子间能形成氢键,H2S分子间的作用为范德华力,氢键的作用大于范德华力,所以沸点:H20>H2S。
考点:本题考查核外电子排布、元素的推断、第一电离能的比较、氢键、化学键。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
如图所示,6个编号分别表示六种物质:Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2。凡是直线相连的两种物质均能发生化学反应(已知高温时氨气能还原Fe2O3。)图中⑤表示的物质是

A.Al或Fe2O3 B.NaOH溶液
C.氢碘酸 D.NH3或O2
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:填空题
(20分)
(1)已知可逆反应:M(g)+N(g)P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 ;
②若反应温度不变,反应物的起始浓度分别为:c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= ;
(2)甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比_______(填“大于”、“小于”或“等于”)10,说明理由_____________________________ 。
(3)25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
①H2SO4溶液: HSO4- | ②NaHSO4溶液: HSO4- | ③盐酸 HCl=H++Cl |
10% | 29% | 100% |
25℃时,0.1mol/L上述几种溶液加入完全一样的等量锌粒,反应速率从大到小的顺序
是 (填序号)
②25℃时,c(H+)相同的上述几种溶液,其物质的量浓度由大到小的顺序是 (填序号)
③25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是________________ 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是 ( )
A.所有自发进行的化学反应都是放热反应 B.自发过程将导致体系的熵增大
C.△H-T△S<0反应能自发进行 D.同一物质的固、液、气三种状态的熵相同
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:选择题
下列情况下,反应速率相同的是 ( )
A.等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
关于反应中的先后顺序,下列评价正确的是
A.向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反应
B.向浓度都为0.1 mol/L 的FeCl3和CuCl2混合溶液中加入铁粉,CuCl2首先反应
C.向浓度都为0.1 mol/LNa2 CO3和NaOH溶液通入CO2气体,NaOH首先反应
D.向浓度都为0.1 mol/L 的FeCl3加入质量相同、颗粒大小相同的铁和铜,铜首先反应
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:填空题
(14分)亚铁氰化钾(K4Fe(CN)6 ,黄血盐)在实验室、电镀、食品添加剂及医学上可用于冶疗铊(Tl)中毒、烧制青花瓷时可用于绘画等有广泛用途。已知HCN是一种极弱的酸。现有一种用含NaCN废水合成黄血盐的主要工艺流程如下:

(1)实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于 溶液,再用蒸馏水稀释,NaCN水解的离子方程式为_________。
(2)实验室K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6],生成的盐又可用于治疗Tl2SO4中毒,试写出上述检验Fe3+反应的离子方程式为 。
(3)流程图中加入碳酸钠溶液主要目的是 。
(4)相同温度下溶解度:Na4[Fe(CN)6] K4[Fe(CN)6](选填:“>”、“=”、“<”)。
(5)长期火炒添加有亚铁氰化钾的食盐,这时会发生分解反应,试配平下列方程式:3K4Fe(CN)6=□KCN+□Fe3C+□C+□(CN)2↑+□N2↑
(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2 (CN)6],写出AgCl与黄血盐制取电镀液的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市高三上学期第三次质检理综化学试卷(解析版) 题型:填空题
(14分)
(1)与OH-电子数和质子数均相同的单核微粒的离子结构示意图为____________
(2)250C时,2.3 g酒精在血液中被氧气完全氧化放出66.8 kJ热量,该反应的热化学方程式为________________(3)汽车安全气囊中含MYn和红棕色金属氧化 物。M、Y为短周期元素,其最外层电子数之和等于氧原子的最外层电子数,且可发生下图的转化。

①写出元素符号:M______;Y_______.
②在2L密闭容器中,起始投入2 mol Y2和3.5 mol H2发生反应II,测得平衡时的数据如表。

若该反应ΔH <0,则T1______T2(填“ >”、“ <”或“=”);在温度T2下,若经过10 min反应达到平衡,则平均速率v(YH3)= ______,平衡常数为______ (保留两位有效数字)
③反应III的化学方程式 为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com