
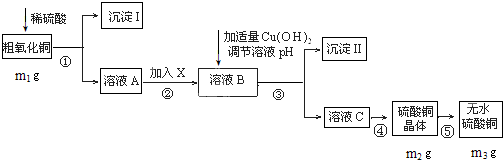
分析 将粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)溶于过量硫酸,发生的反应有FeO+H2SO4=FeSO4+H2O、CuO+H2SO4=CuSO4+H2O,然后过滤,得到沉淀I为不溶于酸的杂质,溶液I中溶质为FeSO4、CuSO4和H2SO4,向溶液I中加入X调节pH过滤,得到溶液B,向溶液B中加入Cu(OH)2调节pH过滤,得到沉淀II,除去FeSO4、CuSO4和H2SO4中的FeSO4,根据氢氧化物沉淀需要的pH知,应该先将FeSO4氧化为铁盐,为不引进新的杂质,氧化剂X应该为Cl2或H2O2,然后向溶液中加入Cu(OH)2调节溶液的pH,所以沉淀II为Fe(OH)3,然后将溶液II蒸发浓缩、冷却结晶得到CuSO4•5H2O,最后在HCl氛围中加热CuSO4•5H2O得到CuSO4,
(1)称量一定质量的药品用到托盘天平,本实验还有过滤和蒸发操作,没用到分液、移液操作;
(2)物质X应选用能将FeSO4氧化为铁盐,同时不引进新的杂质;
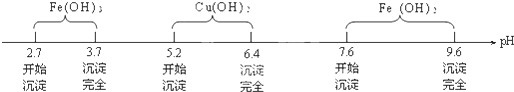
(3)控制溶液的pH在3.7~5.2之间,使Fe3+水解转化为Fe(OH)3,而Cu2+不水解;
(4)由硫酸铜溶液制得硫酸铜晶体,经过加热蒸发硫酸铜溶液,冷却结晶后、过滤、干燥后可得纯净的硫酸铜晶体;
(5)应称量坩埚的质量,坩埚和晶体的质量,加热后坩埚的质量,加热后再称量一次坩埚的质量,判断质量是否发生变化,共称量4次;
a.温度过高,会导致硫酸铜分解,质量变化较大;
b.胆矾晶体的颗粒较大,会导致晶体解热分解不完全,质量变化偏小;
c.在空气中冷却,会吸收空气中的水重新形成晶体;
d.加热胆矾晶体时有晶体从坩埚中溅出,会使结果偏大;
(6)胆矾中的铜元素来自样品和调节pH时加入的氢氧化铜.
解答 解:将粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)溶于过量硫酸,发生的反应有FeO+H2SO4=FeSO4+H2O、CuO+H2SO4=CuSO4+H2O,然后过滤,得到沉淀I为不溶于酸的杂质,溶液I中溶质为FeSO4、CuSO4和H2SO4,向溶液I中加入X调节pH过滤,得到溶液B,向溶液B中加入Cu(OH)2调节pH过滤,得到沉淀II,除去FeSO4、CuSO4和H2SO4中的FeSO4,根据氢氧化物沉淀需要的pH知,应该先将FeSO4氧化为铁盐,为不引进新的杂质,氧化剂X应该为Cl2或H2O2,然后向溶液中加入Cu(OH)2调节溶液的pH,所以沉淀II为Fe(OH)3,然后将溶液II蒸发浓缩、冷却结晶得到CuSO4•5H2O,最后在HCl氛围中加热CuSO4•5H2O得到CuSO4,
(1)实验中用到的化学操作有称量、过滤和蒸发,没有分液、移液操作,分液、移液用到的仪器有分液漏斗、滴定管等,
故答案为:bc;
(2)步骤②加入氧化剂将亚铁离子氧化生成铁离子,然后调节溶液的pH除去铁离子,应选用氧化剂且不引进新的杂质,Fe2+具有还原性,H2O2具有氧化性,二者在酸性条件下发生氧化还原反应:2Fe2++H2O2+2H+=2Fe3++2H2O,符合要求,氢氧化钠无氧化性,铁粉具有还原性,高锰酸钾具有氧化性,但引入新的杂质,
故答案为:b;
(3)由上分析知选择,因为入碱式碳酸铜或氧化铜后,不引入新的杂质,并可降低溶液中H+浓度,控制溶液的pH在3.7~5.2之间,使Fe3+水解转化为Fe(OH)3,而Cu2+不水解,
故答案为:3.7≤pH<5.2;
(4)由硫酸铜溶液制得硫酸铜晶体,向溶液A中加入X调节pH过滤干燥后可得纯净的硫酸铜晶体,
故答案为:加热浓缩、过滤;
(5)测定所得胆矾(CuSO4•xH2O)中结晶水x值,应称量坩埚的质量,坩埚和晶体的质量,加热后坩埚的质量,加热后再称量一次坩埚的质量,判断质量是否在误差允许范围内及两次值是否相差不超过0.1g,共称量4次,
a.加热温度过高,会导致硫酸铜分解,质量变化较大,导致结果偏大,故a正确;
b.胆矾晶体的颗粒较大,会导致晶体解热分解不完全,质量变化偏小,结果偏小,故b错误;
c.加热后放在空气中冷却,会吸收空气中的水重新形成晶体,结果偏小,故c错误;
d.加热过程中有晶体溅失,导致计算出的结晶水质量偏大,计算出的结晶水数目偏高,故d正确;
故答案为:4;ad;
(6)向溶液中加入Cu(OH)2调节溶液的pH,沉淀II为Fe(OH)3,所以胆矾中的铜元素不是都来自样品,因此该小组一位同学根据实验结果求出样品中CuO的质量分数错误,
故答案为:调节pH时加入了氢氧化铜,胆矾中的铜元素不是都来自样品.
点评 本题考查了硫酸铜晶体中结晶水含量的测定,涉及物质制备实验设计、物质分离的实验基本操作,注意掌握测定硫酸铜晶体结晶水含量的方法,理解和掌握物质性质和实验原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 所有的物质中都含有化学键 | |
| B. | 含有非极性键的化合物不一定是共价化合物 | |
| C. | 反应物总能量低于生成物总能量的反应一定是吸热反应 | |
| D. | 由非金属元素构成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇在浓硫酸存在的情况下与乙酸发生酯化反应 | |
| B. | 乙醇与金属钠反应 | |
| C. | 乙醇在浓硫酸作用下的消去反应 | |
| D. | 乙醇与O2的催化氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子交换树脂 | B. | 阴离子交换树脂 | ||
| C. | 阳离子交换树脂和阴离子交换树脂 | D. | 离子交换树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成酸雨的主要物质是硫的氧化物和氮的氧化物 | |
| B. | 海洋元素--溴的提取常用“空气吹出法”,该制备方法中溴元素依次经过被氧化、被还原、被氧化的三过程 | |
| C. | 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 | |
| D. | 水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com