
【题目】下列说法不正确的是
A. 氯气可用于合成药物 B. 碳酸钠可用于治疗胃酸过多
C. 高压钠灯常用来广场照明 D. 镁合金密度小强度大可用于制飞机零部件
科目:高中化学 来源: 题型:
【题目】(1)甲醇蒸气转化为氢气的一种原理是CH3OH和H2O反应生成CO2和H2。
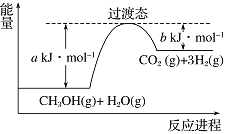
下图是该过程中能量变化示意图。若在反应体系中加入催化剂,反应速率增大,正反应活化能a的变化是___________(填“增大”、“减小”或“不变”),反应热ΔH的变化是________(填“增大”、“减小”或“不变”)。请写出反应进程CH3OH(g)和H2O(g)反应的热化学方程式___________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下4.48 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为________,放出的热量为________kJ(用含有a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项的括号内是除去杂质所用的试剂,错误的是( )
A. Cl2中混有HCl(饱和食盐水)
B. SiO2中混有CaCO3(盐酸)
C. CO2中混有SO2(饱和NaHCO3溶液)
D. FeSO4溶液中混有CuSO4(Zn粉)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)能说明该反应达到化学平衡状态的是 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)830℃时,在1L密闭容器中分别投入lmolH2和1molCO2反应达到化学平街时,CO2的转化率为 保持温度不变.在平衡体系中再充入1molH2和1 molCO2重新达到化学平衡时,CO2 的平衡转化率 (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类或归类中正确的是( )
A. 化合物:HT、CaCl2、NaOH、盐酸
B. 纯净物:水玻璃、胆矾晶体、液氯、硫酸
C. 天然高分子化合物:淀粉、纤维素、蛋白质、聚氯乙烯
D. 同分异构体:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
(1)“酸溶”时加快反应速率的方法有________________________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2+ +2SO42-+16H+,则另一个反应的离子方程式为:___________________;②FeS2还原后,检验Fe3+是否反应完全的方法是_______________________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有____________杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_______________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO.现煅烧23.2kg的FeCO3,得到Fe2O3和FeO的混合物15.84kg.则Fe2O3的质量为___________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E五种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为短周期中原子半径最大的主族元素;E的原子序数为22。
(1)①E被称为“国防金属”和“生物金属”,是重要的结构材料。E原子基态的外围核外电子排布式为 ;
②金红石(EO2)的熔点1825℃,用熔盐法直接电解金红石可获得金属E,金红石所属的晶体类型是 晶体;
③ECl4能与NH4Cl反应生成配合物(NH4)2[ECl6]。此配合物中,形成配位键时提供孤对电子的有 (填元素符号)。与NH4+互为等电子体的一种阴离子为 (填化学式),其中心原子杂化类型为 杂化。
(2)在A、B、C三种元素中,电负性由小到大的顺序是 (用元素符号回答)。
(3)元素A的简单气态氢化物的沸点 (“高于”,“低于”)元素B的简单气态氢化物的沸点,其主要原因是 。
(4)由B形成的离子B3-与AC2互为等电子体,则B3-的
分子构型为 。
(5)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
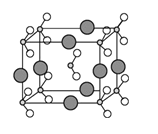
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质、用途与原子(或分子)结构如表所示:
元素编号 | 元素性质与原子(或分子)结构 |
W | 周期表中原子半径最小的元素 |
X | 氢化物可与其最高价氧化物的水化物反应生成盐 |
Y | 一种核素在考古时常用来鉴定一些文物的年代 |
Z | M层比K层少1个电子 |
T | 存在两种同素异形体,其中一种可吸收紫外线 |
(1)元素Y在周期表中的位置第____,元素T的简单离子结构示意图_____。
(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式____________。
(3)元素W与元素X、T可以分别形成多种核外电子总数为10的微粒,其中有四种微粒可以发生反应:甲 + 乙 ![]() 丙 + 丁,该反应为:_____________。
丙 + 丁,该反应为:_____________。
(4)元素X与元素W以原子个数比1∶2化合形成常用于火箭燃料的化合物戊,元素T和元素W以原子个数比为1∶1化合形成化合物己,戊与己能发生氧化还原反应,生成X单质和另一种液体化合物,写出该反应的化学方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com