
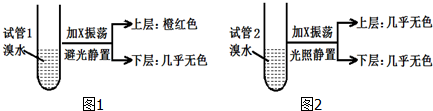
| A. | 相同条件下,X的密度比水小 | |
| B. | X的同分异构体共有5种 | |
| C. | X与溴水因发生加成反应而使溴水褪色 | |
| D. | 实验后试管2中的有机层在上层还是下层,可通过加水确定 |
分析 某烃X与B(乙烷)是同系物,分子中碳与氢的质量比为36:7,则C、H原子数目之比为$\frac{36}{12}$:$\frac{7}{1}$=3:7=6:14,故X分子式为C6H14.
解答 解:某烃X与B(乙烷)是同系物,分子中碳与氢的质量比为36:7,则C、H原子数目之比为$\frac{36}{12}$:$\frac{7}{1}$=3:7=6:14,故X为C6H14,
A.相同条件下,C6H14的密度比水小,故A正确;
B.C6H14的同分异构体有己烷、2-甲基戊烷、3-甲基戊烷、2,3-二甲基丁烷、2,2-二甲基丁烷,故B错误;
C.X为烷烃,不能与溴发生加成反应使溴水褪色,故C错误;
D.发生取代反应得到溴代烃,与水不互溶,可以可通过加水确定试管2中的有机层是上层还是下层,故D正确,
故选:C.
点评 本题考查有机物分子式确定、同分异构体书写、有机物的性质等,侧重考查学生分析推理能力,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷与氢氧化钠溶液共煮后,加入硝酸银检验Br- | |
| B. | 用CuSO4溶液除去由电石和饱和食盐水反应生成的乙炔气体中的杂质 | |
| C. | 用苯、2mol/L的硝酸和3mol/L的硫酸制硝基苯 | |
| D. | 将溴乙烷与氢氧化钠的醇溶液共热后产生的气体通入酸性高锰酸钾溶液以检验乙烯的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸滤既能加快过滤速率和得到更干燥的沉淀,又能使沉淀颗粒变粗变大 | |
| B. | 在“阿司匹林的合成”实验中,把从盐酸中析出的晶体进行抽滤,用酒精洗涤晶体1~2次,然后抽滤,将晶体转移到表面皿上,干燥后称其质量,计算产率 | |
| C. | 记录Na2S2O3与稀硫酸的反应时间,应从溶液混合时开始计时,到刚出现浑浊结束 | |
| D. | 硫酸亚铁铵晶体过滤后用无水乙醇洗涤而不要用水洗涤主要是为了减少晶体损失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时作阳极,放电时作负极 | B. | 充电时作阳极,放电时作正极 | ||
| C. | 充电时作阴极,放电时作负极 | D. | 充电时作阴极,放电时作正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性高锰酸钾溶液鉴别苯、甲苯和环己烯 | |
| B. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| C. | 用水鉴别乙醇、甲苯和溴苯 | |
| D. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IBr的电子式为  | |
| B. | HClO的结构式为H-O-Cl | |
| C. | HIO各原子都满足8电子结构 | |
| D. | 共价化合物内部可能有极性键和非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com