
|
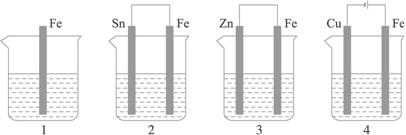
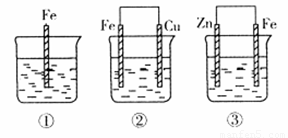
如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是
| |
| [ ] | |
A. |
4>2>1>3 |
B. |
2>1>3>4 |
C. |
4>2>3>1 |
D. |
3>2>4>1 |
|
金属的腐蚀,从本质上讲是组成化学电池发生氧化还原反应的结果.在原电池中,活泼金属为负极,该金属被氧化,不活泼金属便被保护起来,其被腐蚀的速度大大减小,所以装置3中的铁被腐蚀的速度比1中的慢;反之,当铁与比它不活泼的金属,如Sn、Cu等连接起来,则其被腐蚀的速度增大,所以在容器2中的铁比容器1中的铁腐蚀得快.容器4是一个电解池,Fe是阳极,不断地以Fe2+的形式进入容器中,从而加速了铁的腐蚀,在上述四种容器中,容器4中的铁的腐蚀过程是最快的.综上分析,按铁被腐蚀的快慢顺序为:4>2>1>3. 深化升华:金属腐蚀的快慢与下列两种因素有关: (1)与构成微电池的材料有关.两极材料的活动性差别越大,氧化还原反应的速度越快,活泼金属被腐蚀的速度就越快. (2)与金属所接触的电解质强弱有关.活泼金属在电解质溶液中的腐蚀比在非电解质溶液中的腐蚀快,在强电解质溶液中的腐蚀比在弱电解质溶液中的腐蚀快. 一般来说可用下列原则判断: 电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀. |


科目:高中化学 来源: 题型:
A.4>2>1>3 B.2>1>3>
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省滨州市高三第一次(3月)模拟考试理综化学试卷(解析版) 题型:填空题
(l)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点金属。
已知:4Al(s)+3O2(g)=2Al2O3(s) 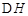 =-2830kJ·mol-1
=-2830kJ·mol-1
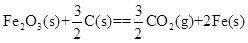
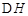 =+230kJ·mol-1
=+230kJ·mol-1
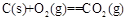
 =-390kJ·mol-1
=-390kJ·mol-1
铝与氧化铁发生铝热反应的热化学方程式是 。
(2)如下图所示,各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ;
②装置中Cu电极上的电极反应式为 。
(3)钒(V)及其化合物广泛应用于新能源领域。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。
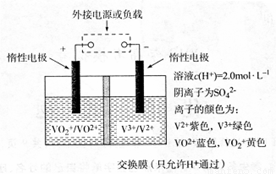
①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色逐渐由 色变为 色。
查看答案和解析>>
科目:高中化学 来源:2013届安徽省高二下学期质量测试4化学试卷(解析版) 题型:选择题
如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是( )
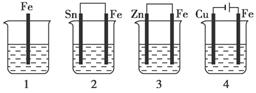
A.4>2>1>3 B.2>1>3>4
C.4>2>3>1 D.3>2>4>1
查看答案和解析>>
科目:高中化学 来源:2013届广东省汕头市高二上学期期末考试化学试卷 题型:选择题
如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是?( )
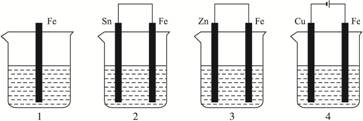
A.4>2>1>3 B.2>1>3>4? C.4>2>3>1 D.3>2>4>1?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com