
【题目】下列措施不符合节能减排的是( )
A. 在屋顶安装太阳能热水器为居民提供生活用热水
B. 大力发展火力发电,解决电力紧张问题
C. 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D. 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑
B.硫酸钠与氯化钡溶液混和:SO42﹣+Ba2+═BaSO4↓
C.硝酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3
D.氧化铜与硫酸混和:Cu2++SO42﹣═CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国药学家屠呦呦因发现植物黄花蒿叶中含贫抗疟疾的物质——青蒿素而荣获2015年诺贝尔奖。科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚。

下列说法错误的是
A. 利用黄花蒿叶研究青蒿素结构的基本步骤为:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
B. ①、②的反应类型分別为还原反应、取代反应
C. 可用质谱法确定分子中含有何种官能团的信息
D. 双氢青蒿素在水中的溶解性大于青蒿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 目前加碘食盐中主要添加的是KIO3
B. 日常生活中和医院常用无水乙醇杀菌消毒
C. 绿色食品是指不含任何化学物质的食品
D. 在空气质量日报中CO2含量属于空气污染指数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)100mL0.2mol/L Na2SO4溶液中含有SO42﹣___________________mol,Na+的物质的量浓度是_________________mol/L。
(2)5molCO2在标准状况下所占的体积约为________L;所含氧原子的数目约为_______个。
(3)3.01×1023个OH﹣的物质的量为___mol,质量为______g,含有电子的物质的量为_______mol,这些OH﹣与___________mol NH3的质量相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国预计在2020年前后建成自己的载人空间站。为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如下图),实现了“太阳能一电能一化学能”转化,总反应方程式为2CO2=2CO+O2 。关于该装置的下列说法正确的是

A.图中N型半导体为正极,P型半导体为负极
B.图中离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的碱性增强
D.人体呼出的气体参与X电极的反应:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”);盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热____________(填“偏大、偏小、无影响”);在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会____________(填“偏大”、“偏小”或“不变”)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会____________(填“偏大”、“偏小”或“不变”),其原因是_______________________________________________。
(4)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则该反应的中和热为ΔH=_______。根据计算结果,写出该中和反应的热化学方程式______________________。
(5)实验中改用60 mL 1.0 mol·L-1的盐酸跟50 mL 1.1mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________ (填“相等”或“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒的原子结构示意图为____________________________;
(2)VO43-的中心原子价层孤电子对数目为______,一个VO43-离子中含有_______个σ键;
(3)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
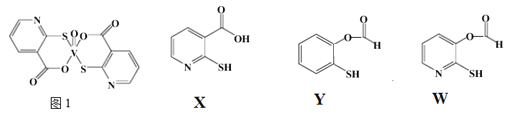
①该药物中N原子的杂化方式是_______;
②X、Y、W三种物质在水中的溶解性由大到小的顺序为________,原因是__________;
已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用![]()
![]() 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为![]()
![]() 。
。
③下列微粒中存在“离域Π键”的是_____;
A.O3 B.SO42- C.H2S D.NO3-
④CS2分子中大π键可以表示为_______________;
(4)偏钒酸铵加热分解生成五氧化二钒、氨气、水。偏钒酸铵的阴离子呈如下图2所示的无限链状结构,则偏钒酸铵的化学式为_________;
(5)某六方硫钒化合物晶体的晶胞如图4所示(![]() 表示V,
表示V,![]() 表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
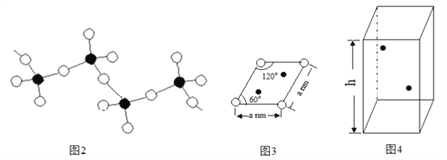
①请在图4中用![]() 标出V原子的位置;
标出V原子的位置;
②已知晶胞的密度为dg/cm3 ,计算晶胞参数h =_____________cm。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 写出下列反应的化学方程式:
(1)丙烯制备聚丙烯:_______________________________________________________;
(2)甲苯与Cl2光照反应生成一氯代物:_______________________________________;
(3)制备硝基苯:___________________________________________________________;
(4)2-甲基-1,3-丁二烯与Br2的1,4-加成反应____________________________;
Ⅱ.核磁共振氢谱是研究有机物结构的有力手段之一。现有某种有机物,通过元素分析得到的数据为C∶85.71%,H∶14.29%(质量分数),质谱数据表明它的相对分子质量为84。
(1)该化合物的分子式为____________。
(2)已知该物质可能存在多种结构,A、B、C是其中的三种,请根据下列要求填空:
①A是链状化合物与氢气加成产物分子中有三个甲基,则A的可能结构有________种(不考虑立体异构)。
②B是链状化合物,1H—NMR谱中只有一个信号,则B的结构简式为______________。
③C是环状化合物,1H—NMR谱中也只有一个信号,则C的结构简式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com