
【题目】某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案一:2.7g Al![]() X溶液
X溶液![]() Al(OH)3沉淀
Al(OH)3沉淀
方案二:2.7g Al![]() Y溶液
Y溶液![]() Al(OH)3沉淀
Al(OH)3沉淀
NaOH溶液和稀盐酸的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是

A. X溶液溶质为AlCl3,Y溶液溶质为NaAlO2
B. b曲线表示的是向X溶液中加入NaOH溶液
C. 在O点时两方案中所得溶液浓度相等
D. a、b曲线表示的反应都是氧化还原反应
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于合金的说法中错误的是
A. 铝合金中除Al外,还含有Cu、Mg、Si、Zn等
B. 生铁和钢都是铁碳合金
C. 我国在商代就已制造和使用的青铜器其成分主要是Cu-Zn合金
D. 金首饰中常加入一定量的Cu或Ag以增大硬度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
回答下列问题:
(1)下列反应不能发生的是: ;
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
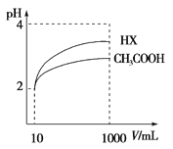
(2)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如右上图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,写出HX的电离方程式 。
(3)某温度下,纯水中c (H+)=2.0×10-7 mol·L1, 0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合后(不考虑溶液体积变化),溶液的pH= 。
(4)等浓度等体积的CH3COONa和NaCN混合后,所得混合溶液中各离子浓度的大小关系是: 。
(5)某二元酸H2B在水中的电离方程式为H2B = H+ + HB— ;HB—![]() H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4 ℃,熔点9.79 ℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
填写下列空白:
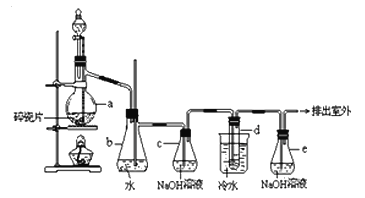
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式: 。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象: 。
(3)容器c中NaOH溶液的作用是: 。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 的说法正确的是( )
的说法正确的是( )
A.所有碳原子有可能都在同一平面上
B.最多只可能有9个碳原子在同一平面上
C.有7个碳原子可能在同一直线上
D.至少有6个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物说法正确的是
A. 乙醇、乙烷和乙酸都可以与钠反应生成氢气
B. 75%(体积分数)的乙醇溶液常用于医疗消毒
C. 苯和乙烯都可使溴的四氯化碳溶液褪色
D. 石油分馏可获得乙酸、苯及其衍生物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是
A.Mg2+、 NH4+、Cl- B.Mg2+、Ba2+、Br-
C.Na+、C1-、I- D.Al3+、HCO3-、C1-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
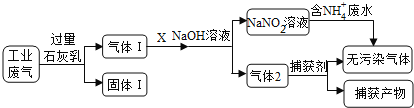
(1)固体I中主要成分为__________,捕获剂所捕获的气体主要是_________。
(2)处理含NH4+废水时,发生反应的离子方程式为___________。
(3)若X为适量空气,严格控制空气用量的原因是____________。
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________________。
增加压强,NO的转化率__________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________(填“增大”、“不变”或“减小”)。
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,C、F的分子式都为C2H4O,F是没有不饱和键的环状有机物,G的分子式为C2H6O2,G中含有两个相同的官能团,转化关系如下图:

己知:同一碳原子上连接2个或2个以上—OH是不稳定结构
请回答:
(1)有机物C中含有的官能团名称是_________________。
(2)有机物E的结构简式______________。
(3)F→G的化学方程式是_______________。
(4)下列说法正确的是____________。
A.有机物D能使石蕊溶液变红
B.用新制碱性氢氧化铜悬浊液无法区分有机物B、C、D的水溶液
C.等物质的量的A和B分别完全燃烧消耗氧气的量相等
D.可用饱和碳酸钠溶液除去有机物E中混有的少量B、D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com