

| A. | +2(a-b-c) kJ•mol-1 | B. | +2(b-a) kJ•mol-1 | ||
| C. | +(b+c-a) kJ•mol-1 | D. | +(a+b) kJ•mol-1 |
分析 根据反应热等于反应物总能量减去生成物总能量计算反应热并书写热化学方程式,注意反应物的物质的量和生成物的聚集状态,由图可以看出$\frac{1}{2}$molN2(g)+$\frac{3}{2}$molH2(g)断裂化学键转化成1molN、3molH吸收能量为akJ,1molN、3molH形成1molNH3(l)放出的能量为(b+c)kJ,则$\frac{1}{2}$molN2(g)与$\frac{3}{2}$molH2(g)反应生成1molNH3(1)的△H=(a-b-c)kJ/mol,据此进行计算.
解答 解:由图可以看出$\frac{1}{2}$molN2(g)+$\frac{3}{2}$molH2(g)断裂化学键转化成1molN、3molH吸收能量为akJ,1molN、3molH形成1molNH3(l)放出的能量为(b+c)kJ,
则$\frac{1}{2}$molN2(g)与$\frac{3}{2}$molH2(g)反应生成1molNH3(1)的△H=(a-b-c)kJ/mol,即$\frac{1}{2}$molN2(g)+$\frac{3}{2}$molH2(g)?NH3(1)△H=(a-b-c)kJ/mol,
所以N2(g)+3H2(g)=2NH3(1)△H=+2(a-b-c)kJ•mol-1,
故选A.
点评 本题考查反应热与焓变的应用,题目难度不大,明确化学键的形成、断裂过程与能量变化的关系为解答关键,注意书写热化学方程式的注意事项以及反应热的计算方法,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
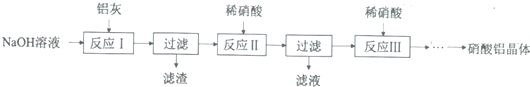
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
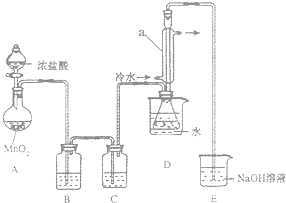 S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
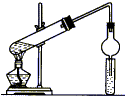 用如图所示装置制取乙酸乙酯,请回答以下问题.
用如图所示装置制取乙酸乙酯,请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ |
 .
. .
. ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
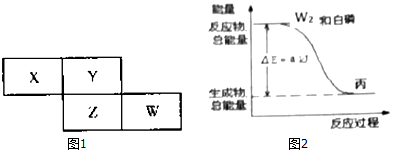
 .
. .白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol.
.白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com