
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
分析 ①FeS2和氧气反应生成二氧化硫,二氧化硫和过氧化氢发生氧化还原反应生成硫酸;
②SiO2属于酸性氧化物,和HCl不反应;
③在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,所以析出NaHCO3,加热NaHCO3分解生成碳酸钠;
④铝和氢氧化钠反应生成偏铝酸钠和氢气,偏铝酸钠和盐酸反应生成氯化铝,氯化铝加热得不到铝;
⑤硫酸铜和过量氢氧化钠溶液反应生成氢氧化铜悬浊液,加入葡萄糖加热反应反应氧化反应生成红色沉淀氧化亚铜.
解答 解:①FeS2和氧气反应4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,二氧化硫和过氧化氢发生氧化还原反应生成硫酸,故①正确;
②SiO2属于酸性氧化物,和HCl不反应,所以不能用二氧化硅和氯化氢制取四氯化硅,故②错误;
③在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,析出NaHCO3,加热NaHCO3分解生成碳酸钠,故③正确;
④铝和氢氧化钠溶液的反应为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,滴加少量盐酸,偏铝酸钠和盐酸反应AlO2-+H++H2O=Al(OH)3↓,滴加过量盐酸,3HCl+Al(OH)3═AlCl3+3H20,AlCl3加热水解,离子方程式为AlCl3+3H2O?Al(OH)3+3HCl,氯化氢易挥发,加热最后得到氧化铝,故④错误;
⑤硫酸铜和过量氢氧化钠溶液反应生成氢氧化铜悬浊液,加入葡萄糖加热反应,发生氧化反应生成红色沉淀氧化亚铜,检验醛基的存在,过程能实现,故⑤正确;
故选A.
点评 本题考查化合物的性质,题目难度中等,熟练掌握物质的性质是解决此类问题的关键,正确运用物质分类及反应规律则是解决此类问题的有效方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硝酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| D | 证明氯化银的溶解度大于硫化银的溶解度 | 向2mL0.1mol•L-1硝酸银溶液中加入1mL0.1mol•L-1NaC1溶液,出现白色沉淀,再加入几滴0.1mol•L-1的Na2S溶液,有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 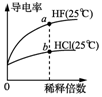 由图可知,a点Kw的数值比b点Kw的数值大 | |
| B. | 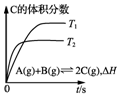 表示在相同的密闭容器中,不同温度下的反应,该反应的△H<0 | |
| C. | 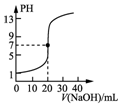 表示0.100 0 mol•L-1 NaOH溶液滴定20.00 mL 0.100 0 mol•L-1醋酸溶液的滴定曲线 | |
| D. |  表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(A)>ω(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液 | |
| B. | 阿司匹林的分子式为C9H10O4 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 1 mol阿司匹林最多可消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
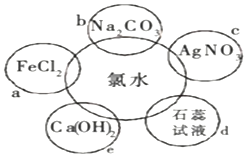 完成下列题目
完成下列题目查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有Fe3+的NaCl溶液中加入适量NaOH溶液,过滤,可除去杂质 | |
| B. | 将含有杂质HC1的Cl2通入饱和食盐水中,可收集到纯净的Cl2 | |
| C. | 某粉末中滴加盐酸,产生能使澄清石灰水变浑池的无色无味气体该粉末为碳酸盐 | |
| D. | 向某溶液中滴加酸化的Ba(NO3)2溶液,出现白色沉淀,则该溶液中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氧化铝与稀硫酸反应Al2O3+6H+═2Al3++3H2O | |
| C. | 氢氧化铝与稀硝酸反应OH-+H+═H2O | |
| D. | 铜与稀硝酸反应:Cu+2H++2NO3-═Cu2++2NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 PH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )
PH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )| A. | ①④ | B. | ②③ | C. | ①② | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com