
| A、合金的熔点一般比组分金属低 |
| B、铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na) |
| C、铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出 |
| D、若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
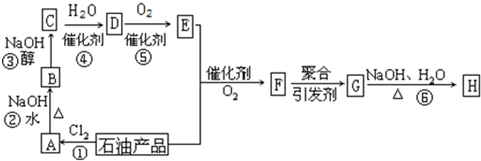
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Ag+、Na+、Ba2+、Fe2+、Al3+ |
| 阴离子 | Cl-、OH-、AlO2-、NO3-、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①CH3COOH | ②H2CO3 | ③H2S | ④H4PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤ | B、③⑥ |
| C、②④⑤ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
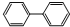 ,下列有关联苯的说法中正确的是( )
,下列有关联苯的说法中正确的是( )| A、分子中含有6个碳碳双键 |
| B、联苯的一硝基取代产物的3种 |
| C、它容易发生加成反应、取代反应,容易被强氧化剂氧化 |
D、它和蒽(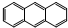 )同属于芳香烃,两者互为同系物 )同属于芳香烃,两者互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com