
| A. | 加入AgNO3溶液后生成的沉淀一定是AgCl | |
| B. | 该混合液中-定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+ | |
| D. | 该混合液中:c(K+)≥0.2mol/L c(CO32-)=0.2mol/L |
分析 ①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
②0.04mol为氨气,溶液中一定含有NH4+,并且物质的量为0.04mol;
③2.33g为硫酸钡,6.27g为硫酸钡和碳酸钡;
再根据电荷守恒,得出一定存在钾离子,据此进行解答.
解答 解:①与AgNO3溶液有沉淀产生的离子有Cl-、CO32-、SO42-;
②加足量NaOH溶液加热产生气体,气体是氨气,故一定有铵离子0.04mol;
③不溶于盐酸的2.33g为硫酸钡,物质的量是0.01mol;6.27g沉淀是硫酸钡和碳酸钡,碳酸钡质量为6.27g-2.33g=3.94g,物质的量为0.02mol,故一定存在CO32-、SO42-,因而一定没有Ba2+;c(CO32-)=0.02÷0.1=0,0.2(mol/L),再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol;c(-)=2c(CO32-)+2x(SO42-)=0.06mol,故一定有K+,至少0.02mol;
综合以上可以得出,一定存在的离子有NH4+、K+、CO32-、SO42-,一定没有的离子Ba2+,可能存在Cl-,
A.加入硝酸银溶液后生成的白色沉淀可能为碳酸银、硫酸银,不一定为氯化银,故A错误;
B.一定存在的离子有NH4+、K+、CO32-、SO42-,一定没有的离子Ba2+,故B错误;
C.该溶液中一定含有钾离子,故C错误;
D.钾离子的浓度≥0.02mol,则c(K+)≥$\frac{0.02mol}{0.1L}$=0.2mol/L;c(CO32-)=$\frac{0.02mol}{0.1L}$=0.2mol/L,故D正确;
故选D.
点评 本题考查了常见离子的检验方法,题目难度中等,根据电荷守恒判断钾离子的存在情况为易错点,注意熟练掌握常见离子的性质及检验方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| B. | 过氧化钠溶于水:2022-+2H2O=4OH-+O2↑ | |
| C. | 用MnO2从酸化的海带灰中浸取液中提取碘:MnO2+2I-+2H2O=Mn2++I2+4OH- | |
| D. | 向偏铝酸钠溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 控制高能耗企业上马 | |
| B. | 加大对污染企业的整治力度 | |
| C. | 无节制地开采煤、石油、天然气等矿物资源 | |
| D. | 倡导“绿色化学”理念,逐步实现化工企业零排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 124 g P4(正四面体结构)含有P-P键的个数为6NA | |
| B. | 18 g NH4+中含有N-H键键长和键能均相同,且个数为4NA | |
| C. | 12 g金刚石中含有C-C键的个数为2NA | |
| D. | 60gSiO2中含Si-O键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
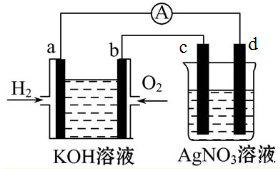
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数用来定量描述化学反应的限度 | |
| B. | 利用化学平衡常数判断化学反应进行的快慢 | |
| C. | 平衡常数的大小与温度、浓度、压强、催化剂有关 | |
| D. | 对于一个化学反应达到平衡之后,若只改变一个因素使得平衡发生移动,则K值一定变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 70% | C. | 50% | D. | 20% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com