
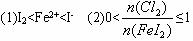
分析图中信息,完成下列各题:
(1)Fe2+、I-、I2的还原性由弱到强的顺序是__________________。
(2)当____________时(填写![]() 的取值范围),发生反应的离子方程式为2I-+Cl2====I2+2Cl-。
的取值范围),发生反应的离子方程式为2I-+Cl2====I2+2Cl-。
![]()
![]()
![]()
(3)6Cl2+2Fe2++10I-====12Cl-+5I2+2Fe3+ (4)![]()
解析:从图中看出,当I-消耗完时Fe2+开始减少,Fe2+氧化完时![]() 开始增加,说明还原性I->Fe2+>I2。因此向FeI2溶液中不断通入Cl2,发生的化学反应为:①Cl2+2I-====2Cl-+I2,②Cl2+2Fe2+====2Cl-+2Fe3+,③5Cl2+I2+6H2O====10Cl-+2IO-3+12H+,当0<
开始增加,说明还原性I->Fe2+>I2。因此向FeI2溶液中不断通入Cl2,发生的化学反应为:①Cl2+2I-====2Cl-+I2,②Cl2+2Fe2+====2Cl-+2Fe3+,③5Cl2+I2+6H2O====10Cl-+2IO-3+12H+,当0<![]() ≤1时,反应按①式进行;当1<
≤1时,反应按①式进行;当1<![]() ≤1.5时,反应按①②式进行;当
≤1.5时,反应按①②式进行;当![]() >1.5时,反应按①② ③式进行。
>1.5时,反应按①② ③式进行。
设FeI2为1 mol,氧化I-需Cl2 1 mol,氧化Fe2+需Cl2 0.5 mol。
剩余Cl2 5 mol-1 mol-0.5 mol=3.5 mol
据5Cl2—2![]()
5 2
3.5 ![]()



 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
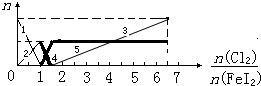
| A、粗线5、细线3分别代表n(Fe3+)、n(IO3-)随n(Cl2):n(FeI2)变化的情况 | B、假设通入Cl2的过程中溶液的体积不变,则溶液的pH始终不变 | C、当n(Cl2):n(FeI2)=6.5时,溶液中n(Cl-):n(IO3-)=13 | D、当n(Cl2):n(FeI2)=1.2时,离子方程式可表示为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
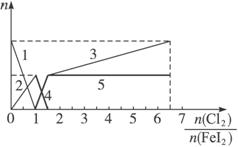
A.粗线5、细线3分别代表n(Fe3+)、n(![]() )随n(Cl2)、n(FeI2)变化的情况
)随n(Cl2)、n(FeI2)变化的情况
B.假设通入Cl2的过程中溶液的体积不变,则溶液的pH始终不变
C.当n(Cl2)∶n(FeI2)=6.5时,溶液中n(Cl-)∶n(![]() )=13
)=13
D.当n(Cl2)∶n(FeI2)=1.2时,离子方程式可表示为2Fe2++10I-+6Cl2====5I2+2Fe3++12Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用下图简单表示(“—”表示铁各种价态的变化,用“—·—”表示碘各种形态的变化)。

据此得出的下列结论中错误的是
A. I-、Fe2+、I2的还原性和Cl2、Fe3+、I2的氧化性都依次减小
B.当n(Cl2)/n(FeI2)==1.2时,离子方程式为2Fe2++10I-+6Cl2==5I2+2Fe3++12Cl-
C.当n(Cl2)/n(FeI2)==6.5时,溶液中n(Cl-)/n(IO3-)==6.5
D.若溶液体积不变,溶液的pH始终不变
查看答案和解析>>
科目:高中化学 来源:河北省2010届高三一模模拟(三)理综化学部分 题型:选择题
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用下图简单表示(“—”表示铁各种价态的变化,用“—·—”表示碘各种形态的变化)。
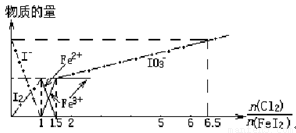
下列结论错误的是( )
A.Cl2、I2、IO3-、Fe3+的氧化性依次减小
B.当n(Cl2)/n(FeI2)=1.2时,反应的离子方程式为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-
C.当n(Cl2)/n(FeI2)=6.5时,溶液中n(Cl-)/n(IO3-)=6.5
D.若溶液的体积不变,则溶液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com