
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W最外层电子数与电子层数相同,Y与X相邻,Y与Z也相邻;元素Z在地壳中含量最高。试回答下列各题:
(1)写出由其中两种元素组成的盐的电子式 。
(2)比较Y、Z离子半径大小 ( 用化学式表示)
(3)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,请写出反应物生成物均为10电子微粒的离子方程式_______________________________________。
(4)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A是日常生活中常用调味品的主要成分,且A与B能够反应生成C,C是一种有香味的液体。试写出该反应的化学方程式____________________________________________。
(5)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式_________________________。
(6)已知由元素X和Z可组成A、B、C、D四种中学化学中常见的单质或化合物,四种物质之间存在如图所示的转化关系。

①写出A与B反应生成C的化学方程式____________________________________;
②向50 mL4 mol·L-1的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中溶质的物质的量之比为__________________________________。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.

查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
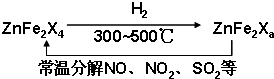
| a |
| Vd-a |
| 1000a |
| 35V |
| 1000b |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com