
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)(×10-4mol•L-1) | 10.0 | 4.05 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO) (×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
分析 (1)根据方程式的加减得出NO与CO催化转化成N2和CO2的化学方程式,焓变相应的加减,从而得出其热化学反应方程式;
(2)利用三段式可计算出平衡时各物质的浓度,再结合v=$\frac{△c}{△t}$计算速率,根据平衡常数的定义计算平衡常数;
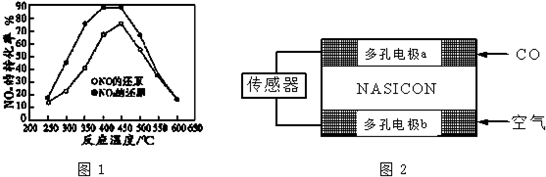
(3)①根据图象分析,NO转化效率比NO2 的低;在250°C-450°C时,NOx转化率随温度升高而增大,450°C-600°C时NOx转化率随温度升高而减小;
②根据外界条件对化学平衡的影响分析,温度越高(450度),二氧化氮的转化率越小,所以该反应是放热反应,且该反应是气体体积增大的反应;
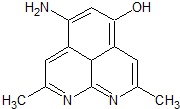
(4)本质是CO与氧气反应生成CO2,CO在a极发生氧化反应,故a为负极.
解答 解:(1)N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol①
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol②
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ③
方程式③×2-②-①得NO (g)+2CO(g)=N2(g)+2CO2(g)
所以△H=(-393.5kJ/mol)×2-(-221.0kJ/mol)-(+180.5kJ/mol)=-746.5 kJ/mol,
故答案为:2NO (g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ/mol;
(2)①根据表中的有关数据,在4s时反应达到平衡,利用三段式,
2NO (g)+2CO(g)=N2(g)+2CO2(g)
起始(×10-4mol•L-1) 10.0 3.60 0 0
3s转化(×10-4mol•L-1) 8.5 8.5 4.25
3s时(×10-4mol•L-1) 1.5 2.75
平衡转化(×10-4mol•L-1) 9.00 9.00 4.50 9.00
平衡(×10-4mol•L-1) 1.00 2.70 4.50 9.00
前2s内的平均反应速率为V(N2)=0.5v(NO)=0.5×$\frac{7.5×1{0}^{-4}}{2}$=1.875×10-4mol/(L.s); T1℃时该反应的平衡常数K=$\frac{9.0{0}^{2}×4.50}{2.7{0}^{2}×1.0{0}^{2}}$×104=5000,
故答案为:1.875×10-4mol/(L.s);5000;
(3)①通过图象知,NO转化效率比NO2 的低;在250°C-450°C时,NOx转化率随温度升高而增大,450°C-600°C时NOx转化率随温度升高而减小;
故答案为:低;在250°C-450°C时,NOx转化率随温度升高而增大,450°C-600°C时NOx转化率随温度升高而减小;
②根据图象知,温度越高(450度),二氧化氮的转化率越小,所以该反应是放热反应,且该反应是气体体积增大的反应;
A、催化剂只改变反应到达平衡的时间,不改变化学平衡状态,故A错误;
B、该反应是放热反应,所以降低温度,平衡向正反应方向移动,增大二氧化氮的转化率,故B正确;
C、分离出H2O(g),减少生成物的浓度,平衡向正反应方向移动,增大二氧化氮的转化率,故C正确;
D、该反应是气体体积增大的反应,增大压强,平衡向逆反应方向移动,二氧化氮的转化率降低,故D错误;
故答案为:BC;
(4)本质是CO与氧气反应生成CO2,CO在a极发生氧化反应,故a为负极,b为正极,阴离子向负极移动,O2-由电极b流向电极a,负极电极反应式为:CO-2e-+O2-═CO2,故答案为:CO-2e-+O2-═CO2.
点评 本题主要考查反应速率的计算、转化率的计算、影响化学反应速率、化学平衡的因素、盖斯定律、原电池、电解池等知识,难度中等,答题时注意盖斯定律的应用时,方程式加减,焓变也应相应的加减,注意化学原理的基础知识的灵活运用.


科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
 .
. ,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)第二周期元素中,第一电离能介于B和O之间的元素有Be、C.
(1)第二周期元素中,第一电离能介于B和O之间的元素有Be、C.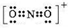 ,其等电子体有N2O、CO2(至少2种).
,其等电子体有N2O、CO2(至少2种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
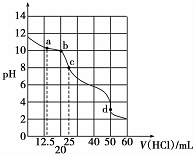 在常温下,0.1000mol•L-1Na2CO3溶液25mL用0.1000mol•L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.1000mol•L-1Na2CO3溶液25mL用0.1000mol•L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO3-)>c(OH-) | B. | b点:5c(Cl-)>4c( HCO3-)+4c(CO32-) | ||
| C. | c点:c( OH -)=c(H+)+c(HCO3-)+2c(H2CO3) | D. | d点:c(H+)=c(CO32-)+c( HCO3-)+c(OH -) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “春蚕到死丝方尽、蜡炬成灰泪始干”中的“丝”的主要成分是纤维素,属于天然高分子化合物 | |
| B. | “千锤万凿出深山,烈火焚烧若等闲”的过程中不但有物理变化,也有化学变化 | |
| C. | 日常生活中常用汽油去除衣物上的油污,用热的纯碱溶液洗涤炊具上的油污,两者的原理完全相同 | |
| D. | “84”消毒液的有效成分为NaClO,“洁厕灵”的有效成分为HCl,若将两者混合使用,其杀菌效果和去除厕所污渍的效果都将加强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60gHCHO和CH3COOH的混合物中存在的π键与σ键的数目总数为8NA | |
| B. | 2L0.5mol•L-1CH3COOD(D为重氢原子)溶液中,CH3COOD和DHO的微粒数之和为NA | |
| C. | 28g核素${\;}_{7}^{14}$N发生下列变化:${\;}_{7}^{14}$+${\;}_{0}^{1}$n→${\;}_{6}^{14}$+${\;}_{1}^{1}$H,通过该化学反应能生成2NA个${\;}_{1}^{1}$H | |
| D. | 450℃时,在催化剂作用下,将2molSO2与一定量的O2混合一段时间后测得SO2消耗$\frac{1}{2}$,则该正反应消耗了NA个SO2分子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
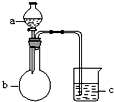 用如图所示装置进行下列实验,a、b和c中所装试剂如下表所示,其中实验现象与结论对应关系不正确的是一组是( )
用如图所示装置进行下列实验,a、b和c中所装试剂如下表所示,其中实验现象与结论对应关系不正确的是一组是( )| 选项 | a | b | c | 现象 | 结论 |
| A | 饱和食盐水 | 碳化钙 | 酸性KMnO4溶液 | c中溶液紫色褪去 | 乙炔具有还原性 |
| B | 浓盐酸 | KMnO4固体 | NaBr溶液 | c中溶液由无色变橙色 | Cl2的氧化性比Br2强 |
| C | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | 碳酸的酸性比硅酸强 |
| D | 硫酸 | Na2SO3固体 | 品红溶液 | c中溶液红色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| CH3COOH | Ka=1.76×10-5 |
| H2SO3 | ${K_{a_1}}$=1.54×10-2 |
| ${K_{a_2}}$=1.02×10-7 | |
| HF | Ka=6.03×10-4 |
| A. | 1mol•L-1NaHA溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH变大 | |
| D. | 已知某温度下常见弱酸的电离平衡常数如表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com