
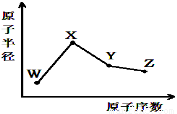
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强。下列说法正确的是
A.对应气态氢化物的稳定性:Y>Z
B.化合物XZW既含离子键也含共价键
C.对应简单离子半径:W>X
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
科目:高中化学 来源:2014-2015江苏省高二上学期期中化学(必修)试卷(解析版) 题型:选择题
“保护环境,就是保护自己。”下列各组中的四种物质都是大气污染物的是
A.SO2、NO2、CO、烟尘 B.CO2、Cl2、N2、雾
C.HCl、NO2、N2、粉尘 D.O2、NO、NH3、H2S
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省肇庆市第二学期高二期末统测化学试卷(解析版) 题型:选择题
下列根据事实所作出的结论正确的是
事实 | 结论 |
A.完全燃烧产物是CO2和H2O的物质 | 一定只含C、H元素 |
B.灼烧棉织品、羊毛衫和涤纶衣物 | 有烧焦羽毛气味的是羊毛衫 |
C.在淀粉溶液中加入市售的加碘食盐不出现蓝色 | 不能说明此盐不含碘 |
D.甲乙两种物质,相对分子质量相同,结构不同 | 甲和乙一定是同分异构体 |
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省珠海市高三学业质量监测二模理综化学试卷(解析版) 题型:选择题
下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3)
B.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+) > c(Cl-) > c(OH-) > c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省、揭阳一中两校届高三5月三模化学试卷(解析版) 题型:简答题
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,
有利于提高SO2的吸收效率。

(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_ (填字母)。





A B C D E
④ 滴定结果如下表所示:
滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 2.20 | 20.20 |
则该药品中Na2SO3的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省、揭阳一中两校届高三5月三模化学试卷(解析版) 题型:选择题
在碱性溶液中能大量共存且为无色透明的溶液是
A.K+、Cl-、MnO4-、SO42- B.Na+、SiO32-、NO3-、CO32-
C.Na+、NO3-、SO42-、HCO3- D.Na+、SO42-、S2-、ClO-
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高一下学期期末考试化学试卷(解析版) 题型:选择题
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
A.未通电前上述镀锌装置可构成原电池,锌为负极,电镀时锌与电源负极相连为阴极
B.电镀时通过1mol电子,阴极上有0.5mol锌的析出
C.未通电前K+向铁极移动,通电后K+还向铁极移动
D.镀锌层破损后对铁制品失去保护作用
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省湛江市高三年级第二次模拟理综化学试卷(解析版) 题型:选择题
常温下关于0.l mol·L-1氯化铵溶液的说法错误的是( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.加入氨水至pH=7, c(NH4+)>c(C1-)
C.滴加浓盐酸可能有,c(NH4+) = c(H+) D.加入少量CH3COONa固体,c(NH4+)减小
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:填空题
(本题16分)降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:

①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________。
②从30分钟到35分钟达到新的平衡,改变的条件可能是 。
A. 增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3  Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为: 。
②电解池中产生CH4一极的电极反应式为: 。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。

下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com