
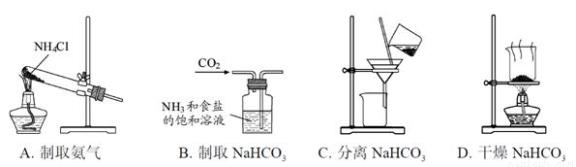
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 火星大气中氮气的体积分数小于地球空气中氮气的体积分数 | |
| B. | 火星大气中二氧化碳的体积分数小于地球空气中二氧化碳的体积分数 | |
| C. | 火星大气中氧气的体积分数大于地球空气中氧气的体积分数 | |
| D. | 火星大气中有稀有气体,地球空气中没有 |
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
按照冶金工业的分类,下列合金属于黑色金属材料的是( )
A.锰钢 B.青铜 C.铝锂合金 D.镧镍储氢合金
查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量 存在的离子是Na+、OH–
存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的 溶液均显中性
溶液均显中性
查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mLCl2,恰好将Fe2+完全氧化。x值为( )
A.0.80 B.0.85 C.0.90 D.0.93
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com