
| ||
| ||
| ||
| A、氧化性(酸性溶液):PbO2>Fe3+>S |
| B、还原性(碱性溶液):Fe(OH)2>KCl>Cl2 |
| C、酸性(水溶液):H2S>H2SO4>H2SeO4>HN3 |
| D、热稳定性:BaCO3>MgCO3>CuCO3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉、胆矾都属于混合物 |
| B、氧化铝、氯化钠都属于离子化合物 |
| C、氯化铵、次氯酸都属于强电解质 |
| D、二氧化硫、二氧化氮都属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小 |
| B、等温下,等浓度的CH3COONa和NaCN溶液pH,后者大 |
| C、HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)-C(OH-)=C(CN-)-C(Na+) |
| D、溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:


 (5)下列关于化合物I、II、V、VI的说法正确的有
(5)下列关于化合物I、II、V、VI的说法正确的有查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
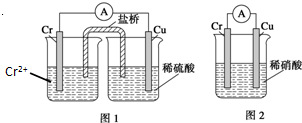 金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).
金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 固体物质中有FeCl3 | |
| 分别向KMnO4溶液中加适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 |
查看答案和解析>>
科目:高中化学 来源: 题型:
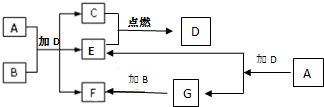 下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.
下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com