
【题目】(1)二氧化碳的摩尔质量是 _________,9g水的物质的量是_____,0.5mol CH4在标准状况下的体积约为_______________。
(2)等质量的CO和CO2在同温同压下的体积之比为_________,所含O原子个数之比为_________。
(3)3.1 g Na2X含有Na+ 0.1 mol,则Na2X的摩尔质量为________,X的相对原子质量为________。。
(4)14 g C2H4与C4H8的混合物所含质子的物质的量为________。
【答案】44 g/mol0.5 mol11.2 L11∶711∶1462 g/mol168 mol
【解析】
(1)二氧化碳的相对分子质量为44,则二氧化碳摩尔质量为44 gmol-1;水的摩尔质量为18g/mol,9g水的物质的量是![]() =0.5mol;0.5mol CH4在标准状况下的体积约为0.5mol×22.4L/mol=11.2L;
=0.5mol;0.5mol CH4在标准状况下的体积约为0.5mol×22.4L/mol=11.2L;
(2)假设质量都为1g,则CO的物质的量为![]() mol、CO2的物质的量为
mol、CO2的物质的量为![]() mol,同温同压下,气体体积之比等于其物质的量之比,CO和CO2的体积之比=
mol,同温同压下,气体体积之比等于其物质的量之比,CO和CO2的体积之比=![]() mol:
mol:![]() mol=11:7;二者含O原子个数之比为
mol=11:7;二者含O原子个数之比为![]() mol×1:
mol×1:![]() mol×2=11:14;
mol×2=11:14;
(3)Na2X中含有的Na+物质的量为0.1mol,则Na2X的物质的量为0.05mol,M(Na2X)=![]() =62g/mol;X的相对原子质量为62-2×23=16;
=62g/mol;X的相对原子质量为62-2×23=16;
(4)C2H4与C4H8的最简式都为CH2,则14g C2H4与C4H8的混合物中含有最简式CH2的物质的量为:n(CH2)=![]() =1mol,1个CH2含有8个质子,则1mol CH2中含有质子的物质的量为:1mol×8=8mol。
=1mol,1个CH2含有8个质子,则1mol CH2中含有质子的物质的量为:1mol×8=8mol。


科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1 mol/L氨水中逐滴加入等浓度的盐酸,溶液中pH与pOH的变化关系如右图所示。下列说法错误的是( )
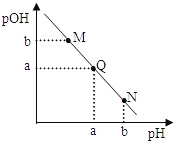
A. 此温度下,水的离子积常数为1.0×10 -2a
B. N点溶液加水稀释,![]() 增大
增大
C. M、Q、N三点所示的溶液中,c(NH4+)+c(H+)=c(OH-)+c(Cl-)
D. Q点消耗的盐酸的体积等于氨水的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸盐在地壳中分布很广,可用蛭石生产硫酸镁和氢氧化镁。某地蛭石的主要成分是[(Mg2.36Fe0.48Al0.16)(Si2.72Al1.28)O10(OH)2] ·[Mg0.32(H2O)0.42],还含有少量杂质FeO。
实验步骤如下:
Ⅰ.制取粗硫酸镁:用硫酸浸泡蛭石矿粉,过滤,将滤液结晶得到粗硫酸镁。
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol·L—1H2O2溶液,再加试剂A调节溶液pH,并分离提纯。
Ⅲ.制取氢氧化镁:向步骤Ⅱ得的溶液中加入过量氨水。
一些金属离子转化为氢氧化物沉淀时溶液的pH如表1所示
表1
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
完全沉淀时 | 3.7 | 5.2 | 9.7 |
请回答:
(1)在步骤Ⅱ中加H2O2溶液的目的是___________。调节溶液pH的范围是______________。试剂A的最佳选择是_________(填字母序号)。
A、MgO B、Na2CO3 C、蒸馏水 D、稀硫酸
(2)测定粗硫酸镁中Fe2+的含量。称取12.3g粗硫酸镁样品溶于水形成溶液,完全转移到锥形瓶中,加稀硫酸酸化,滴加几滴黄色铁氰化钾K3[Fe(CN)6]溶液,用0.010 mol·L—1H2O2溶液进行滴定。平行测定4组,消耗H2O2溶液的体积数据记录如表2所示。
表2
实验编号 | 1 | 2 | 3 | 4 | 平均值 |
消耗H2O2溶液的体积/mL | 12.49 | 12.50 | 13.62 | 12.51 |
①K3[Fe(CN)6]与Fe2+反应生成带有特征蓝色的铁氰化亚铁沉淀,请写出反应的离子方程:________。
②反应达到终点时的标志是_________________________________________________。
③根据表2数据,可计算出粗硫酸镁样品中含有Fe2+_______________mol。
(3)工业上常以Mg2+的转化率为考查指标来确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件。
①步骤Ⅲ中制备氢氧化镁反应的离子方程式为_________________________。
②已知25℃时,Mg(OH)2和Ca(OH)2的Ksp分别为2×10-11和4.7×10—6。若用石灰乳替代氨水,__________(填“能”或“不能”)制氢氧化镁,理由是_____________________________。
③通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,Mg2+完全沉淀时溶液的pH为________。(保留小数点后一位)(已知lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为![]() 的四种溶液pH如下表依据已有的知识和信息判断,下列说法正确的是
的四种溶液pH如下表依据已有的知识和信息判断,下列说法正确的是![]()
溶质 |
| NaClO |
|
|
pH |
|
|
|
|
A. 常温下, ![]() 的水解能力强于其电离能力
的水解能力强于其电离能力
B. 常温下,相同物质的量浓度的![]() 、
、![]() 、
、![]() 依次升高
依次升高
C. ![]() 溶液中存在以下关系:
溶液中存在以下关系: ![]()
D. 向氯水中加入少量![]() 固体,不能增大HClO的浓度
固体,不能增大HClO的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L HCl完全溶于水得到V mL盐酸,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是
①c=![]() ×100% ②c=
×100% ②c=![]() ③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
A. ①④ B. ②③
C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是
A. 9 g![]() 中含有的电子数为3.6 NA
中含有的电子数为3.6 NA
B. 某温度下纯水的pH=6,该温度下1L pH=11的NaOH溶液中含OH-的数目为0.1NA
C. 一定温度下,1 L 0.5 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1NH4Cl溶液含![]() 均为0.5NA
均为0.5NA
D. 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲、乙、丙为组成生物体的相关化合物,乙为一个由α、β、γ三条多肽链形成的蛋白质分子,共含271个氨基酸,图中每条虚线表示由两个硫基(-SH)脱氢形成一个二硫键(-S-S-)。下列相关叙述不正确的是
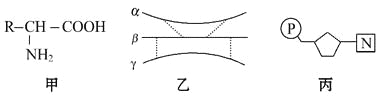
A. 甲为组成乙的基本单位,且乙中最多含有20种甲
B. 由不同的甲形成乙后,相对分子质量比原来少了4 832
C. 丙主要存在于细胞核中,且在乙的生物合成中具有重要作用
D. 如果甲中的R为C3H5O2,则由两分子甲形成的化合物中含有16个H
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com