
下列热化学方程式中ΔH代表燃烧热的是( )
A.CH4(g)+O2(g)===2H2O(l)+CO(g) ΔH1
B.S(s)+O2(g)===SO3(s) ΔH2
C.C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH3
D.2CO(g)+O2(g)===2CO2(g) ΔH4
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源:2015-2016学年江苏省高一下期末化学试卷(解析版) 题型:选择题
除去乙烷中乙烯所需的试剂和方法是
A.溴水,洗气 B.空气,点燃 C.浓硫酸,洗气 D.氢气,加热
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下学期期中化学试卷(解析版) 题型:填空题
A~G是几种烃的分子球棍模型(如图),据此回答下列问题:


(1)常温下含碳量最高的气态烃是________(填字母)。
(2)能够发生加成反应的烃有________种。
(3)一卤代物种类最多的是________(填写字母)。
(4)写出实验室制D的化学方程式:
_____________________________________________________________
(5)写出F发生硝化反应的化学方程式:
_____________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下学期期中化学试卷(解析版) 题型:选择题
相同质量的下列各烃,完全燃烧后生产CO2最多的是 ( )
A.甲烷 B.乙烷
C.乙烯 D.乙炔
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下学期期中化学试卷(解析版) 题型:选择题
通常状况下,下列物质为气体的是( )
A. 甲苯 B. 溴乙烷 C. 四氯化碳 D. 2?甲基丙烷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高一下学期期中化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素的原子序数之和为56,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同。请回答下列问题:

(1)B元素在周期表中的位置为________;
(2)A与氢元素能形成原子物质的量之比为1∶1的化合物,其化学式为________;
(3)C的最高价氧化物的水化物与E单质的反应属于 反应(填“吸热”或“放热”);生成物的总能量 (填“大于”、“小于”或“等于”)反应物的总能量;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高一下学期期中化学试卷(解析版) 题型:选择题
一定量的Fe与过量的盐酸反应制取氢气,下列措施中可加快反应速率的是( )
A.加10mL水 B.增大压强 C.降低温度 D.CuSO4晶体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高二下学期期中化学试卷(解析版) 题型:填空题
钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。
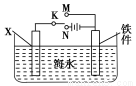
(2)利用右图装置,可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量________3.2 g(填“<”“>”或“=”)。
(4)上图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是 ,若将开关K置于N处,发生的总反应是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期末化学试卷(解析版) 题型:填空题
氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
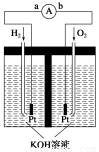
(1)负极反应式为________________________;正极反应式为__________________________。
(2)该电池工作时,H2和O2连续由外部供给,电池可连续不断地提供电能。因此,大量安全储氢是关键技术之一。
金属锂是一种重要的储氢材料,其吸氢和放氢原理如下:
Ⅰ.2Li+H22LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅱ中的氧化剂是________________;
②已知LiH固体密度为0.80g·cm-3,用锂吸收112 L(标准状况下)H2,生成的LiH体积与被吸收的H2体积比为__________(可用分数表示或用a×10-b表示,a保留两位小数);
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com