
| A. | 4项 | B. | 5项 | C. | 6项 | D. | 7 项 |
分析 ①中性溶液中Na+、Cl-、SO42-相互不反应;
②标准状况下,1.12LCO2气体即$\frac{1.12L}{22.4L/mol}$=0.05mol,1L 0.1mol/L的NaAlO2溶液即含0.1molNaAlO2,所以CO2少量反应生成碳酸盐;
③由水电离出的c(H+)=1×10-12mol/L的溶液可能为酸性或者碱性;
④向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀,即按照1:2反应书写离子方程式;
⑤向FeSO4溶液中滴入少量NaClO溶液,并加入适量硫酸,溶液立即变黄,即ClO-在酸性条件下将Fe2+氧化成Fe3+;
⑥25℃,c(H+)=1×10-13 mol•L-1的溶液中即在碱性条件下Mg2+、Cu2+会形成沉淀;
⑦0.1mol•L-1 NH4HCO3溶液中,K+、Na+、NO3-、Cl-相互不反应;
⑧抗氧化剂应具有还原性;
⑨0.1mol/L、pH=1的NaHA溶液,说明NaHA完全电离出氢离子;
⑩H2SO3为弱酸应分布电离.
解答 解:①中性溶液中Na+、Cl-、SO42-相互不反应,所以中性溶液中可能大量存在、Na+、Cl-、SO42-,故正确;
②标准状况下,1.12LCO2气体即$\frac{1.12L}{22.4L/mol}$=0.05mol,1L 0.1mol/L的NaAlO2溶液即含0.1molNaAlO2,所以将1.12LCO2气体通入1L 0.1mol/L的NaAlO2溶液中CO2少量反应生成碳酸盐,则化学方程式为:CO2+3H2O+2NaAlO2═2Al(OH)3↓+Na2CO3,故错误;
③由水电离出的c(H+)=1×10-12mol/L的溶液可能为酸性或者碱性,酸性溶液中H+与NO3-结合成硝酸氧化I-,碱性条件下与Mg2+形成氢氧化镁沉淀,故错误;
④向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀,即按照1:2反应,则离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓,故正确;
⑤向FeSO4溶液中滴入少量NaClO溶液,并加入适量硫酸,溶液立即变黄,即ClO-在酸性条件下将Fe2+氧化成Fe3+,离子方程式为:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O,故正确;
⑥25℃,c(H+)=1×10-13 mol•L-1的溶液中即在碱性条件下Mg2+、Cu2+会形成沉淀,所以25℃,c(H+)=1×10-13 mol•L-1的溶液中,Mg2+、Cu2+、不可能大量共存,故错误;
⑦0.1mol•L-1 NH4HCO3溶液中,K+、Na+、NO3-、Cl-相互不反应,所以0.1mol•L-1 NH4HCO3溶液中,K+、Na+、NO3-、Cl-可以共存,故正确;
⑧食品中的抗氧化剂具有还原性,本身是易被氧化的物质,故错误;
⑨0.1mol/L、pH=1的NaHA溶液,说明NaHA完全电离出氢离子,则向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液,反应的离子方程式为:H++OH-=H2O,故错误;
⑩SO2的水溶液显酸性是因为SO2与水反应生成H2SO3,H2SO3为弱酸应分布电离,电离方程式为:H2SO3?H++HSO3-,故错误.
所以不正确的有②③⑥⑧⑨⑩共6项,
故选:C.
点评 本题主要考查离子方程式以及离子共存的判断,为高考的高频题,题目难度不大,注意离子共存和离子反应所限定的条件,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:实验题
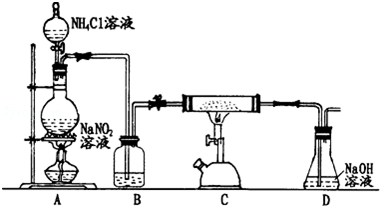
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
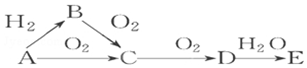 已知A是气体单质,E的水溶液显强酸性.A、B、C、D、E是含有一种相同元素的五种物质,在一定条件下可发生如图所示的转化.
已知A是气体单质,E的水溶液显强酸性.A、B、C、D、E是含有一种相同元素的五种物质,在一定条件下可发生如图所示的转化.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
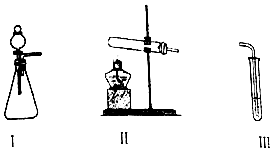
| 操作 | 现象 | |
| 甲 | 向I中加入必要的试剂,并向III中加入KI、淀粉溶液.连接I、III,打开活塞 | I中剧烈反应,产生无色气体并伴随大量白雾;III中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向II中加入必要的试剂,并向III中加入KI、淀粉溶液和稀硫酸.连接II、III,点燃酒精灯 | III中有气泡冒出,溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
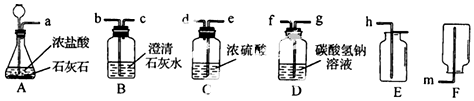
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
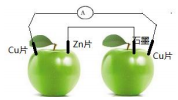 如图所示,在两个绿苹果中插入Cu片、Zn片和石墨棒,然后用导线连接,电流计指针偏转,则下列说法正确的是( )
如图所示,在两个绿苹果中插入Cu片、Zn片和石墨棒,然后用导线连接,电流计指针偏转,则下列说法正确的是( )| A. | 该装置为两个原电池串联 | B. | Zn片为电源负极 | ||
| C. | 两个Cu片均不参加反应 | D. | 石墨上有O2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:W>Y>Z | |
| B. | Z的单质不能与水反应 | |
| C. | 简单氢化物的沸点:W>Y | |
| D. | 最高价氧化物对应的水化物的酸性:X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com