
某同学在实验室从如图K352中(Ⅰ)标签的试剂瓶中取少许钠进行燃烧实验,如图K352中(Ⅱ)。

(Ⅰ) (Ⅱ)
图K352
(1)装置A的名称为________;实验中,观察到的淡黄色的固体物质是________(写化学式);观察到的黄色火焰是________元素的发射光谱。
(2)实验后发现还有少许黑色固体生成。
从反应物及实验操作猜测:该黑色物质可能为碳与另一种氧化物组成的混合物。
则该氧化物可能是________或________(写化学式)。
(3)对黑色固体物质的组成做如下探究:
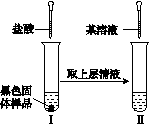
图K353
①实验Ⅰ中加入盐酸的目的是________________________________________________________________________
________________________________________________________________________。
②仅通过实验Ⅱ,用最简的步骤能快速确定黑色物质的组成,请完善该设计。
[限选试剂:稀盐酸、KSCN溶液、K3Fe(CN)6溶液、10%的H2O2溶液]
| 实验操作 | 预期的现象与结论 | 相关化学方程式 |
| 取少量实验Ⅰ中的澄清溶液,加入________ | ________________________________________________________________________ | ________________________________________________________________________ |
(1)坩埚 Na2O2 Na(或钠)
(2)Fe3O4 FeO
(3)①检验黑色固体物质中是否有碳,同时溶解氧化物
②适量的KSCN溶液
如果溶液显红色,则黑色物质为Fe3O4,反之则为FeO(如果对Fe2+继续检验,只要答案正确也可)
Fe3++3SCN-===Fe(SCN)3
[解析] (1)加热固体所用仪器的名称为坩埚。钠与氧气加热反应生成的是Na2O2,钠的焰色反应呈黄色。
(2)钠中所含的杂质是铁,在加热条件下铁与氧气反应可能生成黑色的FeO和Fe3O4。
(3)①加入盐酸,若有不溶解的黑色固体,说明固体中含有碳;若固体完全溶解,则固体中不含碳。Fe3O4中含有Fe3+和Fe2+,而FeO中只含Fe2+,故可以通过检验溶液中是否含Fe3+,确定是FeO或Fe3O4。


科目:高中化学 来源: 题型:
1~20号元素(稀有气体元素除外)中:
(1)原子半径最小的 ,是原子半径最大的是 。
(2)与水反应最剧烈的金属单质是 ,非金属单质是 。
(3)既能与酸反应,又能与碱反应的金属单质是 。
(4)硬度最大的单质是 。
(5)气态氢化物的水溶液酸性最强的是 。
(6)最高价氧化物对应的水化物碱性最强的是 。(以上填元素符号)
(7)铅是碳的同族元素,比碳多4个电子层,铅在周期表的位置为 周期、第 族。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备下列气体时,所用方法正确的是( )
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制乙烯时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
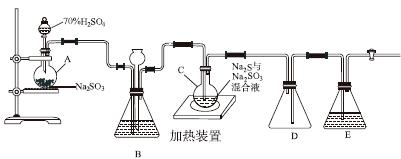
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是__________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O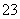 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:

(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为__________________;该操作将I2还原为I-的目的是______________________。
(2)操作X的名称为________。
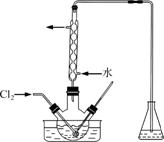
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。
实验控制在较低温度下进行的原因是______________;锥形瓶里盛放的溶液为________。
(4)已知:5SO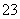 +2IO
+2IO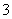 +2H+===I2+5SO
+2H+===I2+5SO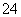 +H2O
+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO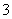 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO 的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;________________________________________________________________________
的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下,2.24 L苯中约含有个NA碳原子
B.标准状况下,22.4 L H2中含中子数为2NA
C.1 L 1 mol/L醋酸溶液中离子总数为2NA
D.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
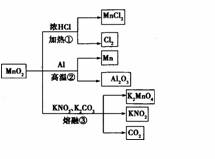
MnO2的一些性质或用途如图,下列说法正确的是 ( )
A.①、②、③三个反应中Mn02均作氧化剂
B.足量Mn02与2 L 10 mol/l、 HCl共热,可生成5 mol C12
C.反应②若生成1 mol Al203,则反应过程中转移12 mol电子·
D.反应③中K2CO3和KNO3的化学计量数均为1
查看答案和解析>>
科目:高中化学 来源: 题型:
2012年3月22日是第二十届“世界水日”,保护水资源,从我做起!
(1)C102和C12(还原产物都为Cl一)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,C102的消毒效率是C12的 倍。
(2)自来水厂常用高铁酸钠(Na2Fe04,强氧化剂)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理: .
(3)某无色废水中可能含有Fe3+、A13+、Mg2+、Na+、NO3-、CO32一、SO42-离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如图所示:

请根据上图回答下列问题:
①实验中需配制1.0 mol/l的NaOH溶液80 ml,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为 。
③试确定NO3-是否存在? (填“存在”“不存在”或“不确定”),若存在,试计算
c(NO3-) (若不存在,此问不必作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在实验室合成了一种物质A。
⑴经分析,A的相对分子质量不超过100,A中C、H的质量分数分别为:
w(C)=69.76%,w(H)=11.63%,且完全燃烧后产物只有CO2和H2O。
则A的摩尔质量为 __________ 。
⑵ A的核磁共振氢谱如下图所示,且A可以和金属钠反应生成H2,但不能在Cu作催化剂下被催化氧化。(提示:羟基与碳碳双键相连的结构不稳定)
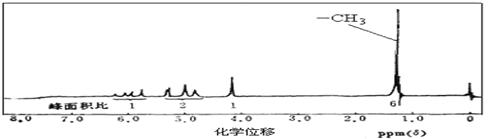
请根据以上信息写出A的结构简式 。
(3)A的某种同分异构体B分子中不含支链,能发生银镜反应。
请写出B发生银镜反应的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com