
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”, S2O32-与Cl2反应的产物之一为SO42一。下列说法中,错误的是 ( )
| A.该反应中的氧化剂是C12 |
| B.SO2与氯水的漂白原理相同,所以可用S02做纺织工业的漂白剂 |
| C.上述反应中,每生成1 mol SO42一,可脱去2 mol C12 |
| D.根据该反应可判断还原性:S2O32->C1— |
科目:高中化学 来源: 题型:填空题
某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、CuCl2中的一种或几种组成,
现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
⑴混合物中是否存在CuCl2 (填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4 (填“是”或“否”),你的判断依据是 。
⑶写出反应③中的离子方程式
。
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)。
___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用FeC13溶液吸收多余的SO2气体。
(1)写出SO2与FeC13溶液反应的离子方程式: 。
(2)FeC13溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有:H+、Fe2+、C1—、SO42-。某同学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-
假设2:还存在Fe3+
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
| 实验步骤 | 现象和结论 |
| 步骤1:取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴 溶液。 | 现象: 结论:假设1不成立。 |
| 步骤2: | 现象: 结论:假设2成立。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列是氧化还原反应也是吸热反应的是( )
| A.灼热的炭与二氧化碳反应 | B.铁和稀硫酸的反应 |
| C.氢氧化钡晶体的粉末和氯化铵晶体混合 | D.钢铁制品生锈的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将1.52 g的铜镁合金完全溶解于50mL14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加人1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.若该浓硝酸的密度为1.40g/mL则该浓硝酸的溶质质量分数为63% |
| B.该合金中铜与镁的物质的最之比是2:1 |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加人NaOH溶液的体积是620 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
4.6g铜镁合金完全溶解于100mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到4480mLNO2和336 mLN2O4的混合气体(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是46:69 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol·L-1 |
| C.产生沉淀8.51 g |
| D.离子恰好完全沉淀时,加入NaOH溶液的体积是230mL |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某实验小组依据反应 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是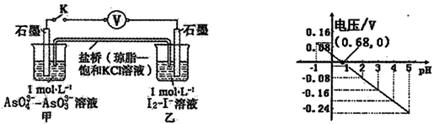
A.调节pH可以改变反应的方向
B.pH = 0.68时,反应处于平衡状态
C.pH = 5时,负极电极反应式为2I--2e- =I2
D.pH >0.68时,氧化性I2〉AsO43-
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2 =" d" Fe3++ e Br2+ f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A.2 4 3 2 2 6 | B.0 2 1 0 1 2 |
| C.2 0 1 2 0 2 | D.2 2 2 2 1 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com