
| A | B | C | D |
 |  |  |  |
| 探究温度对盐的水解反应的影响 | 测定一定时间内生成H2的反应速率 | 比较不同催化剂对反应速率的影响 | 量取15.00mL稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
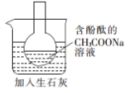
分析 A.加入生石灰后溶液温度升高,根据溶液颜色变化可以判断温度对盐的水解的影响;
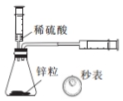
B.根据一定时间内注射器中生成气体的量可以计算生成氢气的速率;
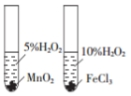
C.比较不同催化剂对反应速率的影响时,双氧水的浓度必须完全相同;
D.滴定管的最小读数为0.01mL,可用酸式滴定管量取稀盐酸.
解答 解:A.醋酸钠水解生成醋酸和氢氧化钠,该反应为可逆反应,石灰石与水的反应为放热反应,加入生石灰后溶液温度升高,可以根据溶液颜色变化判断温度对盐的水解的影响,故A正确;
B.锌与稀硫酸反应生成氢气,通过秒表控制时间,结合注射器中生成氢气的体积可以定一定时间内生成H2的反应速率,故B正确;
C.试管中双氧水的浓度不同、催化剂类型不同,有两个变量,无法比较不同催化剂对反应速率的影响,故C错误;
D.稀硫酸呈酸性,且滴定管的最小读数为0.01mL,可用酸式滴定管量取15.00mL稀盐酸,故D正确;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及盐的水解原理、反应速率影响及测定、滴定管使用等知识,明确常见化学实验基本操作方法为解答关键,注意掌握化学反应速率及其影响,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:实验题
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
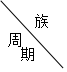 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 氯化钠与浓硫酸混合加热:H++Cl-$\frac{\underline{\;\;△\;\;}}{\;}$HCl↑ | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含Fe3+和NO3-,无I-和Cl- | B. | 含I-,不含Fe3+、NO3-,可能有Cl- | ||
| C. | 含NO3-,不含Fe3+、I-,可能有Cl- | D. | 含I-、Fe3+,不含Cl-,可能有NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
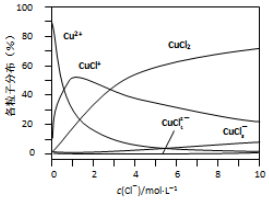
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置可构成原电池.试回答下列问题:
如图所示装置可构成原电池.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com