
在实验室测定碳酸钠与碳酸氢钠的混合物中,碳酸钠的质量分数[用符号w(Na2CO3)表示],称取此混合物5.lg,溶于水中,配成250mL溶液。
a.(10分)方案一:沉淀法测w(Na2CO3)利用化学反应把HCO3-、CO32-完全转化为沉淀,称取沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选的试剂是___________? (填编号)。
A.CaCl2?????? B.MgSO4????? C. .NaCI????? D.Ba(OH)2
(2)简述证明HCO3-、CO32-已完全沉淀的实验操作_________________________。
(3)过滤,提取沉淀,则过滤操作所需要的玻璃仪器有________________________。
(4)洗涤沉淀,简述洗涤沉淀的操作_____________________________。
(5)干燥充分,称取沉淀的质量为9.8g,由此计算w(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得w (Na2CO3)________________(填偏大或偏小、无影响)。
b.方案二:滴定法测w(Na2CO3)量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L的盐酸进行滴定到终点。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。????? [已知饱和的碳酸溶液PH为3.9]
(1)量取25.00 mL配制好的溶液,应选择_______________仪器来完成。
(2)判断滴定终点的依据是_____________________,此过程中反应的离子方程式为__________________________________________________。
(3)此法测得w(Na2CO3)=________%(保留两位小数)
a(1)D
(2)静止,澄清,然后向上层清液中滴加Ba(0H)2溶液,若有沉淀产生,说明未沉淀完全,反之,则沉淀完全
(3) 烧杯、普通漏斗、玻璃棒
(4) 向漏斗的沉淀上加蒸馏水使其没过沉淀,过滤,重复操作2到3次
(5) 偏小
b(1)碱式滴定管
(2)溶液由红色变为无色,且半分钟内不变色? H++CO32-=HCO3-
(3)83.14
【解析】
试题分析:a(1)A、CaCl2不与HCO3-反应,错误;B、MgSO4不与HCO3-反应,错误;C、NaCI均不反应,错误;D 、Ba(0H)2均反应生成沉淀,正确,答案选D。
(2)溶液中若存在HCO3-、CO32-,则继续滴加Ba(0H)2溶液会有沉淀产生,所以证明HCO3-、CO32-已完全沉淀的实验操作是:静止,澄清,然后向上层清液中滴加Ba(0H)2溶液,若有沉淀产生,说明未沉淀完全,反之,则沉淀完全
(3)过滤操作所需要的玻璃仪器有:烧杯、普通漏斗、玻璃棒
(4)洗涤沉淀的操作是:向漏斗的沉淀上加蒸馏水使其没过沉淀,过滤,重复操作2到3次
(5)沉淀未干燥会导致沉淀的质量增大,从而计算出的碳酸钠的质量减小,所以测得w (Na2CO3)偏小
b((1)(3)每空2分,(2)每空1分)
(1)碳酸钠与碳酸氢钠的溶液显碱性,应用碱式滴定管量取
(2)碳酸钠与碳酸氢钠的溶液显碱性,使酚酞试液变红,所以滴定终点时溶液由红色变为无色,且半分钟内不变色;方案b中用酚酞作指示剂,所以滴定终点时的溶液仍为碱性,即盐酸滴定碳酸钠和碳酸氢钠的混合液时,盐酸与碳酸钠反应生成碳酸氢钠,不产生二氧化碳气体,所以此过程发生的离子方程式为H++CO32-=HCO3-
(3)由(2)知H+~CO32-因此由消耗盐酸的体积可计算出碳酸钠的物质的量n(Na2CO3)=0.2mol/L×20×10-3L=0.004mol,所以原溶液中碳酸钠的质量为
0.004mol×10×106g/mol=4.24g,则w(Na2CO3)=4.24g/5.1g×100%=83.14%
考点:考查试剂的选择,沉淀完全的判断,洗涤操作,误差分析,仪器的选择,质量分数的计算


科目:高中化学 来源: 题型:
 I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:c(
| ||
c(
|
 H++HA- HA-
H++HA- HA- H++A2-
H++A2-查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.0 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
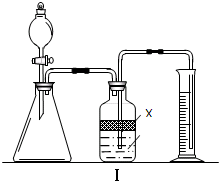 实验室中可用盐酸滴定的方法测定Na2CO3或NaHCO3的含量.测定Na2CO3时,若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时,Na2CO3完全转化为NaHCO3;测定NaHCO3时,若用甲基橙作指示剂,逐滴加入盐酸至溶液由黄色变橙色时NaHCO3完全转化为CO2逸出.
实验室中可用盐酸滴定的方法测定Na2CO3或NaHCO3的含量.测定Na2CO3时,若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时,Na2CO3完全转化为NaHCO3;测定NaHCO3时,若用甲基橙作指示剂,逐滴加入盐酸至溶液由黄色变橙色时NaHCO3完全转化为CO2逸出.| 实验步骤 | 结果分析 |
| 步骤①:取少量样品于试管中,加入适量蒸馏水使之溶解, |
有白色沉淀生成,说明产品中含有NaC1 |
| 步骤②:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积Vl; |
品中含有NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
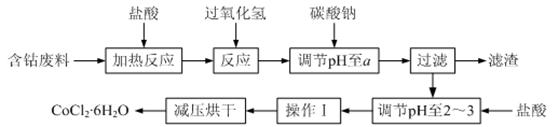
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
请回答下列问题:
⑴在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 ▲ 。
⑵加入碳酸钠调节pH至a,a的范围是 ▲ 。
⑶操作Ⅰ包含3个基本实验操作,它们是 ▲ 和过滤。
⑷制得的CoCl2·6H2O需减压烘干的原因是 ▲ 。
⑸为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 ▲ 。
⑹在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com