
【题目】乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为2CH2=CH2+O2===2CH3CHO.下列有关说法不正确的是
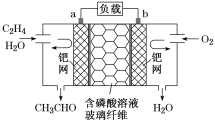
A. 每有0.1molO2反应,则迁移H+0.4mol
B. 负极反应式为CH2=CH2-2e-+H2O=CH3CHO+2H+
C. 电子移动方向:电极a→磷酸溶液→电极b
D. 该电池为不可充电电池
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】已知可逆反应2SO2+O2![]() 2SO3是放热反应,下列说法正确的是( )
2SO3是放热反应,下列说法正确的是( )
A.2 molSO2与1molO2能完全反应生成2 mol SO3,升高温度可以加快此反应的化学反应速率
B.2molSO2与1molO2不能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率
C.2mol SO2与1 molO2能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
D.2molSO2与1molO2不能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糠叉丙酮(![]() )是一种重要的医药中间体。下列关于该化合物的说法错误的是( )
)是一种重要的医药中间体。下列关于该化合物的说法错误的是( )
A.分子式为C8H8O2,不属于芳香族化合物
B.能发生氧化反应、水解反应和取代反应
C.1mol糠叉丙酮最多可与3molBr2发生加成反应
D.存在能与NaHCO3反应且属于芳香族的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
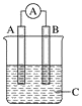
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按图所示的装置进行电解实验。下列说法正确的是( )
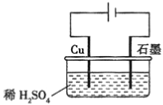
A. 电解过程中,铜极上有H2生成
B. 电解初期,主反应方程式为:2H2O=H2↑+O2↑
C. 整个电解过程中,H+的浓度不断增大
D. 电解一定时间后,石墨电极上有铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
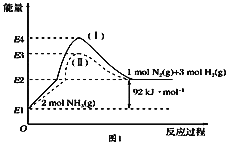
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为___________________.
②过程(Ⅰ)和过程(Ⅱ)的反应热________(填“相同”或“不同”).
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为____________.
b.N2的平衡转化率为________.
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡________(填“正向”“逆向”或“不”)移动.
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g)![]() 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=_____(用含a、c的代数式表示),K3=_____(用K1和K2表示).反应Ⅲ中的ΔS______(填“>”“<”或“=”)0.
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:
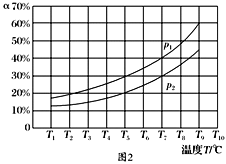
①分析得p1________p2.(填“>”“<”或“=”)
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是________(填序号).
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关浓H2SO4的叙述中,正确的是( )
A.浓H2SO4与铜片共热的反应中,浓H2SO4既表现出强氧化性,又表现出酸性
B.浓H2SO4与金属活动性顺序中氢后面的金属反应生成的气体一般为H2
C.常温下,铁或铝不与浓H2SO4反应,所以可用铁或铝制的容器贮存浓H2SO4
D.浓H2SO4是不挥发性强酸,氢硫酸是挥发性弱酸,所以可用浓H2SO4与FeS反应制取H2S气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请正确表示下列化学用语:乙炔(结构式)__________;甲烷(空间构型)_________;羟基(电子式)_________;C22-(电子式)_________ ;异戊二烯(结构简式)______________。
(2)高分子化合物![]() 是由三种单体通过加聚反应而制得的。这三种单体的结构简式是____________、____________、____________;
是由三种单体通过加聚反应而制得的。这三种单体的结构简式是____________、____________、____________;
(3)书写化学方程式并注明反应类型(有机物写结构简式):
①CH3-CH2-Br与氢氧化钠溶液在加热条件下的反应方程式:_______________________(____________);
②甲苯制备TNT:__________________________(_____________)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:
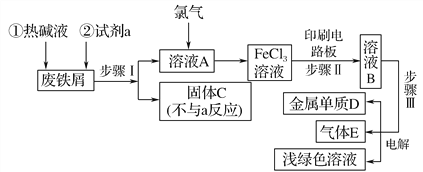
(1)试剂a应选用________(填写名称);
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、________(填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式____________________;
(4)实验室制取气体E的离子方程式是________________________,欲对气体E进行干燥和吸收,需选用下列装置中的________(填写序号);
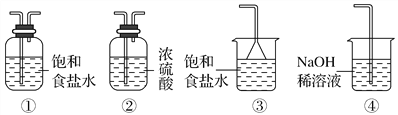
(5)如何用化学方法检验气体E?______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com