

分析 (1)反应物为甲烷和水,条件是高温、催化剂,产物之一是氢气,甲烷完全燃烧产物是二氧化碳,不完全燃烧产物为一氧化碳,据此写出反应的化学方程式;
(2)依据反应原理推断设备A的名称以及书写化学反应方程式即可;
(3)依据反应中的生成物回答需要的原料,依据化学反应原理写出化学反应方程式;
(4)依据纯碱在生产生活的用途进行解答;
(5)①根据滤液中是否含有氯离子或钡离子判断沉淀是否洗涤干净;
②依据质量分数的表达式计算出样品中NaCl的质量分数.
解答 解:(1)依据题给的信息,甲烷与水在高温催化剂作用下生成二氧化碳(或一氧化碳)和氢气,故化学反应方程式为:CH4+2H2O $\frac{\underline{\;催化剂\;}}{高温}$CO2+4H2或CH4+H2O$\frac{\underline{\;催化剂\;}}{高温}$CO+3H2,
故答案为:CH4+2H2O $\frac{\underline{\;催化剂\;}}{高温}$CO2+4H2或CH4+H2O$\frac{\underline{\;催化剂\;}}{高温}$CO+3H2;
(2)在生产中,设备A中应生成目标产物纯碱,故A为沉淀池,发生的反应为:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,
故答案为:沉淀池;NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓;
(3)副产物为氯化铵,需要引入氯离子,且目标产物为纯碱,故在通入氨气的同时,加入NaCl,尿素的水解生成氨气和二氧化碳,故反应为:CO(NH2)2+H2O=2NH3↑+CO2↑,
故答案为:NaCl;CO(NH2)2+H2O=2NH3↑+CO2↑;
(4)纯碱在日常生活中应用广泛,常用于制玻璃、制肥皂、造纸、纺织、印染等,
故答案为:制玻璃、制肥皂;
(5)①检验沉淀是否洗净的方法为:往少量的最后一次洗涤所得滤液中加入稀H2SO4溶液(或AgNO3溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀,则沉淀已洗涤干净,
故答案为:往少量的最后一次洗涤所得滤液中加入稀H2SO4溶液(或AgNO3溶液),若产生白色沉淀,则沉淀没有洗涤干净,若无白色沉淀,则沉淀已洗涤干净;
②生成ng固体为BaCO3,其物质的量为:$\frac{ng}{197g/mol}$,则碳酸钠的质量为:$\frac{ng}{197g/mol}$×106g/mol=$\frac{106n}{197}$g,
故氯化钠的质量为(m-$\frac{106n}{197}$)g,则氯化钠的质量分数为:($\frac{m-\frac{106n}{197}}{m}$)×100%=(1-$\frac{106n}{197m}$)×100%,
故答案为:(1-$\frac{106n}{197m}$)×100%.
点评 本题考查了工业合成氨的原理,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力,明确合成原理为解答关键.


科目:高中化学 来源: 题型:解答题
 碳和硫的化合物在生产和生活中的应用非常广泛,清洁能源的开发、煤的综合利用等是实验“低碳生活”、减少空气污染的重要途径,试运用所学知识,回答下列问题:
碳和硫的化合物在生产和生活中的应用非常广泛,清洁能源的开发、煤的综合利用等是实验“低碳生活”、减少空气污染的重要途径,试运用所学知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
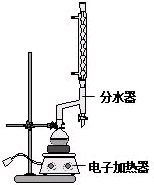 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)基态铬原子的价电子排布式为3d54s1.
(1)基态铬原子的价电子排布式为3d54s1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸(
水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A | ||
| B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


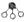 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com