
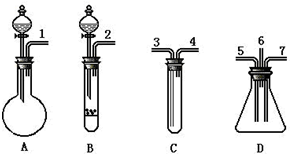
 根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:

 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
| A、是配制一定物质的量浓度的溶液的专用仪器 |
| B、容量瓶可以用来加热 |
| C、不能用容量瓶贮存配制好的溶液 |
| D、可以用500mL容量瓶配制250mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5作为空气质量预报的一项重要指标,它是指空气中直径大于或等于2.5μm的颗粒物,该值越高,代表空气污染程度越严重 |
| B、新型材料聚酯纤维、光导纤维都属于有机高分子 |
| C、上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念 |
| D、塑化剂是一种化工塑料软化剂,可以大量添加到婴幼儿玩具中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
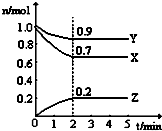 某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
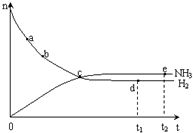 合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g)△H<0
合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g)△H<0| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
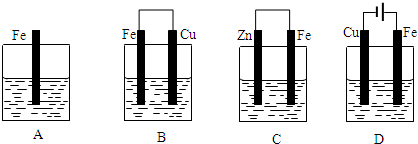
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com