
氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇,在工业上应用广泛。工业上制取氯化亚铜的工艺流程如下:
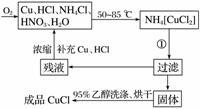
实验药品:铜丝20 g、氯化铵20 g、65%硝酸10 mL、36%盐酸15 mL、水。
(1)反应①的化学方程式为____________________,
用95%乙醇代替蒸馏水洗涤的主要目的是_______________________(写出一条即可)。
(2)工业化生产时,95%乙醇可通过__________的方法回收并循环利用,而NH4Cl、____________(填化学式)可直接循环利用。
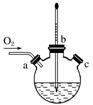
(3)实验室用右图装置制备CuCl。
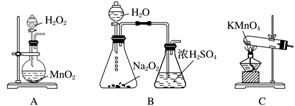
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择下列装置中的________(填字母)。
②实验开始时,温度计显示反应液温度低于室温,主要原因是_________________。
电炉加热升温至50 ℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当______________________________时才能停止通入氧气;待冷却至室温后,再打开瓶塞,沿________(填字母)口倾出棕色反应液于1 000 mL大烧杯中,加水500 mL,即有大量白色沉淀析出。
答案 (1)NH4[CuCl2]===CuCl↓+NH4Cl 避免CuCl溶于水而造成损耗(洗去晶体表面的杂质离子及水分)
(2)蒸馏 HNO3 (3)①B ②氯化铵溶于水吸收大量热,造成反应液温度降低 烧瓶上方红棕色气体逐渐变为无色 a(或c)
解析 (1)注意反应①的反应物和生成物即可确定该反应的化学方程式为NH4[CuCl2]===CuCl↓+NH4Cl。用95%乙醇代替蒸馏水洗涤的主要目的是洗去晶体表面的杂质离子及水分,减小CuCl的溶解损失,同时可以加快固体的干燥。(2)将乙醇与水分离的操作是蒸馏,根据残液浓缩后的补充物质可知,可直接循环利用的有NH4Cl和HNO3。(3)在题给三个装置中,能观察到产生O2速率的只有B。实验开始时,温度计显示反应液温度低于室温的主要原因是氯化铵溶于水时吸热,造成反应液温度降低。为使反应产生的氮氧化物完全转化为硝酸,消除氮氧化物对环境的影响,因此需到烧瓶上方红棕色气体逐渐变为无色时才能停止通入氧气。将三颈瓶中液体倒出时利用左口或右口,即从a口或c口倾出棕色反应液。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
下列关于有机物的说法中错误的是( )
A.石油裂解能得到乙烯,乙烯是生产聚乙烯的原料
B.甲烷、苯都属于烃,都不存在同分异构体
C.葡萄糖可转化为乙醇,乙醇氧化可得到乙醛
D.煤干馏是复杂的物理化学变化,石油分馏是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1 Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O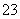 将转化为( )
将转化为( )
A.S2- B.S C.SO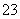 D.SO
D.SO
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
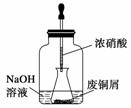
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70 ℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式____________。
(2)上图装置中NaOH溶液的作用是_____________________。
(3)步骤二中,水浴加热所需仪器有________、________(加热、夹持仪器、石棉网除外),水浴加热的优点是_________________________。
(4)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
 CaCl2固体 30%的H2O2
CaCl2固体 30%的H2O2











NH3 副产品 产品
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________________________________________________________________________
________________________________________________________________________。
(2)检验“水洗”是否合格的方法是________。
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①________________________________________________________________________;
②________________________________________________________________________。
(4)测定产品中CaO2含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
(已知:I2+2S2O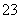 ===2I-+S4O
===2I-+S4O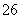 )
)
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在0 ℃、1.01×105 Pa时进行下列实验:甲、乙、丙三位同学各取30.0 mL同浓度的盐酸,加入相同组成的镁铝合金粉末,测定产生气体的体积,有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 510 | 765 | 918 |
| 气体体积(mL) | 560 | 672 | 672 |
试求:(1)盐酸的物质的量浓度是多少?
(2)合金中各成分的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是用铁铆钉固定两个铜质零件的示意图,若该零件置于潮湿空气中,下列说法正确的是( )
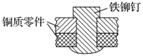
A.发生电化学腐蚀,铜为负极,铜极产生H2
B.铜易被腐蚀,铜极上发生还原反应,吸收O2
C.铁易被腐蚀,铁发生氧化反应,Fe-2e===Fe2+
D.发生化学腐蚀:Fe+Cu2+===Cu+Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com