
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- | H2SO4 | O2- | 35Cl |
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3->Al3+ | H2SO4<HClO4 | O2-<S2- | 35Cl=37Cl |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 NaOH溶液与0.2 mol?L-1 CH3COOH溶液等体积混合后:c(CH3COOH)+c(CH3COO-)=0.1mol?L-1 |
| B、常温下,将CH3COONa和HCl两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c (CH3COOH) |
| C、pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③ |
| D、25℃时,pH=a的盐酸与pH=b的Ba(OH)2溶液等体积混合后,恰好完全反应,则a+b=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
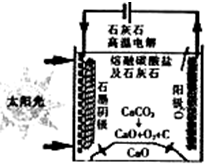 资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡前,随着反应的进行,容器内气体密度逐渐减小 |
| B、平衡时,该反应放出的热量为Q kJ |
| C、平衡后,再向容器中通入1mol 氦气,A的转化率增大 |
| D、平衡后,缩小容器体积,A的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2具有氧化性,可用于漂白纸浆 |
| B、FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
| C、明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| D、Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol N2所含有的原子数为NA |
| B、1 mol?L-1 NaCl溶液中含有的钠离子数目为NA |
| C、标准状况下,22.4 LCO所含的原子数为NA |
| D、24 g O2和24 g O3所含的氧原子数都是1.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com