
| ���� | 1-���� | ���ᶡ�� | |
| �۵㣨�棩 | 16.6 | -89.5 | -73.5 |
| �е㣨�棩 | 117.9 | 117 | 126.3 |
| �ܶȣ�g/cm3�� | 1.05 | 0.81 | 0.88 |
| ˮ���� | ���� | ���ܣ�9g/100gˮ�� | �� |

���� ��1����Ӧ�����ᡢ1-�����ķе���ڲ������ᶡ���ķе㣬���ü�װ�ã�����ɷ�Ӧ��Ĵ����ӷ�������˷�Ӧ���ת���ʣ���װ�ú�����������װ�ã���߷�Ӧ���ת���ʣ�
��2��1-������Ũ���ᡢ���������¿��Է�����ȥ��Ӧ�ͷ��Ӽ���ˮ��Ӧ�����Կ������ɵĸ������У�CH3CH2CH2CH2OCH2CH2CH2CH3��CH3CH2CH=CH2��
��3������Ӱ�컯ѧƽ������ؽ��н�����1-����ת���ʣ�����������һ�ַ�Ӧ��Ũ�ȣ���������Ũ�ȣ�������������Ũ�ȣ�
��4���ᴿ���������ᶡ������Ҫͨ����Һ����������Ҫ���������˲�����
��5����Һ©����������ʵ��ǰ�������Ƿ�©ˮ���������©���ڲ�δ�������ͨ���������ϵİ���δ��©�����ϵ�С������Һ©���е�Һ�嶼����������
��� �⣺��1�����ݱ������ݿ�֪����Ӧ�����ᡢ1-�����ķе���ڲ������ᶡ���ķе㣬�����ü�װ�ã�����ɷ�Ӧ��Ĵ����ӷ��������˷�Ӧ���ת���ʣ���װ�ú�����������װ�ã���������������Ӧ���߷�Ӧ���ת���ʣ�����ѡ��װ�ã�
�ʴ�Ϊ���ң����ڷ�Ӧ�����ᡢ1-�����ķе���ڲ������ᶡ���ķе㣬�����ü�װ�ã�����ɷ�Ӧ��Ĵ����ӷ���
��2��1-������Ũ�����������ܹ�������ȥ��Ӧ����1-��ϩ���ṹ��ʽΪ��CH3CH2CH=CH2��Ҳ�ܹ�������������ˮ����CH3CH2CH2CH2OCH2CH2CH2CH3��
�ʴ�Ϊ��CH3CH2CH2CH2OCH2CH2CH2CH3��CH3CH2CH=CH2��
��3��Ҫ���1-������ת���ʣ��������������Ũ�ȣ�ʹ����Ӧ��������ƽ�����������ƶ���Ҳ���Լ�С������Ũ�ȣ��淴Ӧ���ʼ�С��ƽ�����������ƶ���
�ʴ�Ϊ����������Ũ�ȣ���С������Ũ�ȣ��������������
��4����Ӧ��Ļ�����У������ܺ�ˮ���ܣ�1-����������ˮ�����Կɼ��뱥��̼������Һ����һ���������ᶡ����ˮ�е��ܽ�ȣ�Ȼ���Һ�ɵ����ᶡ��������Ҫʹ�ù��ˡ������Ȳ���������һ��ʹ�õIJ���Ϊac��
�ʴ�Ϊ��ac��
��5��ʹ�÷�Һ©��ǰ����Ӧ����Ƿ�©ˮ���������Һ���������������ܷ�Һ©���Ͽڲ������ϵİ���δ��©�����ϵ�С������©���ڲ�δ����������ͨ��Һ�����ʱ����Һ©���ڵ�ѹǿ��С��Һ�������Ե��£����߲�����δ��Һ�岻�ܵ��£�
�ʴ�Ϊ������Ƿ�©ˮ���������Һ©���Ͽڲ������ϵİ���δ��©�����ϵ�С������©���ڲ�δ����������ͨ��������δ����
���� ���⿼�������ᶡ������ȡ��������Ŀ�Ѷ��еȣ�ע���������ᶡ���ķ�Ӧԭ������ȡ���������ᶡ������ȡװ��������������װ�ò�ͬ����Ҫ���ݷ�Ӧ����������е��С�ķ�����


 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д� ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʹƷ����Һ��ɫ | |
| B�� | NO2 ͨ��ˮ�У������ɺ���ɫ��ת��Ϊ��ɫ | |
| C�� | ����Ƭ����CuSO4��Һ�У���Ƭ�����к�ɫ���ʳ��� | |
| D�� | ���������Һ�еμ�������ϡ���ᣬ�����������γ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭNaOH��Һ��Ũ����1.00mol/L�����ù�����Na2CO3 | |
| B�� | ԭNaOH��Һ��Ũ����0.500mol/L�����ù�����Na2CO3��NaHCO3 | |
| C�� | ԭNaOH��Һ��Ũ����1.00mol/L�����ù�����Na2CO3��NaOH | |
| D�� | ԭNaOH��Һ��Ũ����0.90mol/L�����ù�����Na2CO3��NaHCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
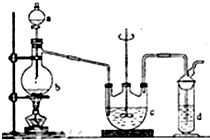 ��������ƣ�Na2S2O3���������մ����������Լ�����������ˮ�������ھƾ������ȡ������ֽ⣮��ҵ�Ͽ�����Ʊ�����Ӧԭ����
��������ƣ�Na2S2O3���������մ����������Լ�����������ˮ�������ھƾ������ȡ������ֽ⣮��ҵ�Ͽ�����Ʊ�����Ӧԭ����| ʵ����� | 1 | 2 | 3 |
| Na2S2O3��Һ�����mL�� | 19.98 | 20.02 | 21.18 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
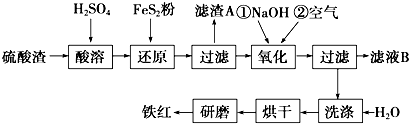
| ������ | Fe��OH��3 | Al��OH��3 | Fe��OH��2 | Mg��OH��2 |
| ��ʼ����pH | 2.7 | 3.8 | 7.6 | 9.4 |
| ��ȫ����pH | 3.2 | 5.2 | 9.7 | 12.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ | B�� | �ƾ� | C�� | �� | D�� | �⻯����Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com