
下列关于价电子构型为3s23p4的粒子描述正确的是( )
|
| A. | 它的原子核外有三种形状不同的电子云 |
|
| B. | 它的原子核外电子共有16种不同的运动状态 |
|
| C. | 它可与H2反应生成的化合物为非极性分子 |
|
| D. | 核外电子轨道表示式为: |
考点:
原子核外电子排布.
专题:
原子组成与结构专题.
分析:
A.电子云的形状种数由该原子能级种类确定;
B.原子核外电子运动状态和该原子的核外电子数相等;
C.硫与氢气反应生成硫化氢为极性分子;
D.3p能级上电子排布图违反洪特规则;
解答:
解:A.价电子构型为3s23p4的元素是16号元素S,具有s和p两种能级,因此该原子的电子云形状有两种,故A错误;
B.S原子具有16个核外电子,处于不同能层、能级上的电子具有的能量不同,同一能级上的电子自旋方向相反,故有16种不同的运动状态,故B正确;
C.硫和氢气化合生成的硫化氢,分子构型V型,为极性分子,故C错误;
D.电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,所以3p能级上电子排布图违反洪特规则,故D错误;
故选:B.
点评:
本题考查原子核外电子排布,明确构造原理、洪特规则等知识点是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:
下列实验操作正确的是( )
|
| A. | 将氢氧化钠固体放在滤纸上称量 |
|
| B. | 用10mL量筒量取8.58mL蒸馏水 |
|
| C. | 制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 |
|
| D. | 配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到氢气bmol,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为( )
A.  mol B. (a﹣b)mol C.
mol B. (a﹣b)mol C.  mol D. (a+b)mol
mol D. (a+b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
甲乙两人分别用不同的方法配制100ml 3.6mol/L的稀硫酸.
(1)甲:量取20ml 18mol/L浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100ml 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀.
①实验所用的玻璃仪器除烧杯和容量瓶外,还有 ;
②将溶液转移到容量瓶中的正确操作是 ;
③定容的正确操作是 .
(2)乙:用100ml 量筒量取20ml 浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100ml 刻度线,再搅拌均匀.
你认为此法是否正确?若不正确,指出其中错误之处 .
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数,下列说法中正确的是( )
|
| A. | 7.8g过氧化钠固体中含阴离子个数为0.2NA |
|
| B. | 34g氨气中含N﹣H的数目为6NA |
|
| C. | 标准状况下,22.4L乙炔中含π键数为2NA |
|
| D. | 1molNaHSO4晶体中阳离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学﹣﹣选修化学与技术】
下图是某工厂对海水资源进行综合利用的示意图.
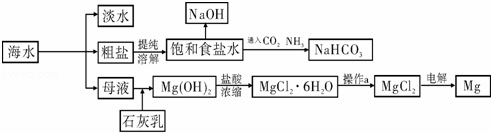
请回答下列问题:
(1)请列举一种海水淡化的方法 .;
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是 ,NaOH在电解槽的 室生成,由饱和食盐水制取NaOH的化学方程式为 ↑ ;
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是 .再由NaHCO3制得纯碱,化学方程式为 .
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
结合表中数据和实际生产情况说明,工业上生产镁采用电解MgCl2而不是电解MgO的理由 . .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com