
分析 常温下,该烃是气态烃,说明C原子个数小于5,设该气态烃的分子式为CxHy,相同条件下,气体的体积之比等于其物质的量之比等于计量数之比,
CxHy(g)+(x+0.25y)O2(g)$\frac{\underline{\;点燃\;}}{\;}$xCO2(g)+0.5yH2O(l) 气体计量数减少,
1 (1+x+0.25y-x)
10mL (10+50-35)mL
1:(1+x+0.25y-x)=10mL:(10+50-35)mL
据此计算y值,从而确定气态烃的化学式.
解答 解:常温下,该烃是气态烃,说明C原子个数小于5,设该气态烃的分子式为CxHy,相同条件下,气体的体积之比等于其物质的量之比等于计量数之比,
CxHy(g)+(x+0.25y)O2(g)$\frac{\underline{\;点燃\;}}{\;}$xCO2(g)+0.5yH2O(l) 气体计量数减少,
1 (1+x+0.25y-x)
10mL (10+50-35)mL
1:(1+x+0.25y-x)=10mL:(10+50-35)mL
y=6,
所以符合条件的气态烃为C2H6、C3H6、C4H6,
答:符合条件的该烃的分子式为C2H6、C3H6、C4H6.
点评 本题考查有机物化学式的确定,为高频考点,侧重考查学生分析计算能力,熟悉常见有机物在常温下的状态,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 氧化反应一定属于化合反应 | CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O |
| 生成盐和水的反应一定是中和反应 | Ca(OH)2+CO2═CaCO3↓+H2O |
| 只有在加热或高温条件下才能冶炼出金属 | Fe+CuSO4═FeSO4+Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
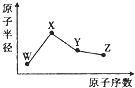 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )| A. | 简单离子半径:W>X>Z | |
| B. | 最简单气态氢化物的稳定性:Y<Z | |
| C. | 化合物XZW中既含离子键又含共价键 | |
| D. | Y的氧化物能与X的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验中温度计的水银球应插入液态混合物中 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 分液时,打开旋塞,使下层液体从下口流出,上层液体从上口倒出 | |
| D. | 开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH[Ba(OH)2]:使用Na2SO4溶液 | B. | KOH(K2SO4):使用Ba(OH)2溶液 | ||
| C. | NaCl(Na2SO4):使用Ba(NO3)2溶液 | D. | HNO3(HCl):使用AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有较高能量的反应物分子称为活化分子 | |
| B. | 升高温度增大了活化分子百分数 | |
| C. | 化剂能够改变化学反应途径 | |
| D. | 增大压强能提高活化分子的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数K=0.4 | |
| B. | 反应达平衡后,升高温度,平衡正向移动 | |
| C. | 4s内,用A表示的该反应的平均反应速率v(A)=0.01mol/(L•s) | |
| D. | 830℃下反应达平衡时,B的转化率为20% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com