
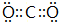 ;
;分析 某淡黄色固体甲,隔绝空气加热后可生成化合物A以及气体B和C,B与A继续加热可生成一黑色能被磁铁吸引的单质D和C,C是一种温室气体,能使澄清石灰水变浑浊,则D为Fe、C为CO2,气体B具有还原性,可知B为CO,甲中含有Fe、C、O三种元素,将A溶于盐酸,并往其中滴加KSCN溶液无明显现象,则A中不含+3价碳元素,应含有+2价Fe元素.分解得到CO、CO2平均相对分子质量为22.4×1.61=36,故CO、CO2的物质的量之比为(44-36):(36-28)=1:1,则总质量为10.8g-5.4g=5.4g,总物质的量为$\frac{5.4g}{36g/mol}$=0.15mol,则n(CO)=n(CO2)=0.075mol,由于CO、CO2的物质的量相等,可推知A为FeO,其物质的量为$\frac{5.4g}{72g/mol}$=0.075mol,由元素守恒可知化合物甲中n(Fe):n(C):n(O)=0.075mol:(0.075mol+0.075mol):(0.075mol+0.075mol+0.075mol×2)=1:2:4,故甲的化学式为FeC2O4,据此解答.
解答 解:某淡黄色固体甲,隔绝空气加热后可生成化合物A以及气体B和C,B与A继续加热可生成一黑色能被磁铁吸引的单质D和C,C是一种温室气体,能使澄清石灰水变浑浊,则D为Fe、C为CO2,气体B具有还原性,可知B为CO,甲中含有Fe、C、O三种元素,将A溶于盐酸,并往其中滴加KSCN溶液无明显现象,则A中不含+3价碳元素,应含有+2价Fe元素.分解得到CO、CO2平均相对分子质量为22.4×1.61=36,故CO、CO2的物质的量之比为(44-36):(36-28)=1:1,则总质量为10.8g-5.4g=5.4g,总物质的量为$\frac{5.4g}{36g/mol}$=0.15mol,则n(CO)=n(CO2)=0.075mol,由于CO、CO2的物质的量相等,可推知A为FeO,其物质的量为$\frac{5.4g}{72g/mol}$=0.075mol,由元素守恒可知化合物甲中n(Fe):n(C):n(O)=0.075mol:(0.075mol+0.075mol):(0.075mol+0.075mol+0.075mol×2)=1:2:4,故甲的化学式为FeC2O4.
(1)由上述分析可知,B的化学式为CO,C为CO2,电子式为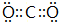 ,
,
故答案为:CO;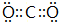 ;
;
(2)气体C与Mg反应的化学方程式为:CO2+Mg$\frac{\underline{\;点燃\;}}{\;}$C+2MgO,
故答案为:CO2+Mg$\frac{\underline{\;点燃\;}}{\;}$C+2MgO;
(3)甲的化学式为FeC2O4,若甲在密闭容器中充分反应生成D(Fe),化学反应方程式为:FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$Fe+2CO2↑,
故答案为:FeC2O4;FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$Fe+2CO2↑;
(4)甲分解产生A、B、C属于氧化还原反应型的分解反应,A、D为非氧化还原反应,B、C属于氧化还原反应,故选:BC.
点评 本题考查无机物推断,属于计算型推断,是对学生综合能力的考查,较好的考查学生分析推理能力,难度中等.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
 ,Z的化学式SiO2;
,Z的化学式SiO2;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.5mol•L-1 | B. | 5mol•L-1 | C. | 6mol•L-1 | D. | 8mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z三种元素在周期表中处于同一周期 | |
| B. | 同主族元素中的X的气态氢化物最稳定 | |
| C. | 同一周期元素中Z的最高价氧化物对应的水化物酸性最强 | |
| D. | Y、Z所形成的化合物属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
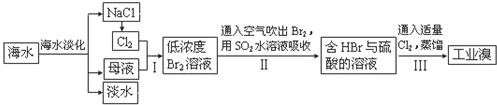
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 油脂和汽油都属于酯类,都能用作工业制肥皂 | |
| C. | 纯碱可用于生成普通玻璃,日常生活中也可能用初年溶液来除去物品表面的油污 | |
| D. | 雾霾严重影响了人们的正常生活,为改善空气质量,可以加高工厂的烟囱,使灰尘和废气远离地表 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是半导体材料,可用于制备光导纤维 | |
| B. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com