
| A. | ①②③⑤ | B. | ①③④ | C. | ②⑤⑥ | D. | ①③④⑤ |
分析 在分子中以及水溶液或熔化状态下不能电离产生氯离子的物质,不含氯离子,以此来解答.
解答 解:①氯气和水反应生成盐酸和次氯酸,氯化氢能电离出氯离子,所以氯水中含有氯离子,故①不选;
②氯化氢气体为分子构成的物质,只含氯化氢分子不含氯离子,故②选;
③氯化氢在水溶液里能电离出氯离子,所以盐酸中含有氯离子,故③不选;
④熔融氯化钠能电离产生氯离子,故④不选;
⑤氯酸钾溶液中电离产生钾离子和氯酸根离子,不产生氯离子,所以不含氯离子,故⑤选;
⑥四氯化碳为分子构成的物质,只含四氯化碳分子不含氯离子,故⑥选;
故选C.
点评 本题考查含氯元素的物质,明确物质的构成及物质发生电离能否产生氯离子即可解答,题目难度不大.


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 青蒿素(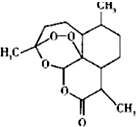 )可能具有氧化性 )可能具有氧化性 | |
| B. | “.煤改气”、“煤改电”等有利于减少雾霾天气 | |
| C. | 侯氏制碱法中,向饱和NaCI溶液中先通人NH3,再通人CO2 | |
| D. | 洁厕剂(含HCI )和漂白粉混合使用可使去污效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7.0的降水通常称为酸雨 | |
| B. | 燃煤时加入适量石灰石,可减少废气中SO2的量 | |
| C. | 新制氯水经光照一段时间pH增大 | |
| D. | 测定氯水的pH应用干燥的pH试纸,不能用蒸馏水润湿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al<Mg<F | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 事实 | 原因 | |
| A | 稀有气体的晶体属于原子晶体 | 其组成微粒是原子 |
| B | 键的极性H-O>H-S | 氧的电负性强于S的电负性 |
| C | HF稳定性比HI强 | HF分子间能形成氢键而HI不能 |
| D | 金刚石的熔沸点高于晶体硅 | C-C键能大于Si-Si键能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基的电子式为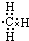 | |
| B. | 大量获得乙烯的工业方法是乙醇的消去反应 | |
| C. | C3H8只能表示一种物质 | |
| D. | 乙烷在光照的条件下与氯气混和,最多可以生成10种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含X与Y的化合物只有2种 | |
| B. | Y、W的氧化物均为酸性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X与Z形成的化合物中,各原子均满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
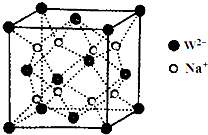 前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题:
前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com