

| A. | 丙中一定含有羧基 | B. | 甲不可以与HBr发生取代反应 | ||
| C. | 甲、乙、丙都能发生氧化反应 | D. | 可以用溴水检验乙中的碳碳双键 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
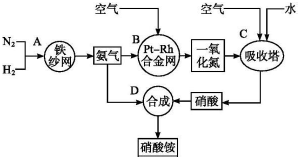
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能呈酸性 | B. | 不可能呈碱性 | ||
| C. | 可能呈中性或碱性 | D. | 不可能呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 污染 | 废旧热固性塑料 | 煤燃烧 | 含Hg2+的工业废水 | 生活垃圾 |
| 方法 | 粉碎作为填充剂 | 煤中加入适量石灰石 | 加入Na2S溶液 | 焚烧发电 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
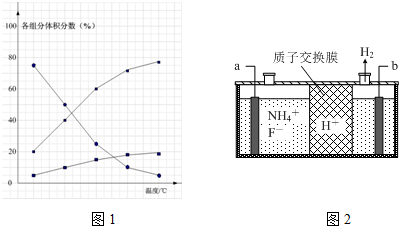
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,容量瓶无“0”刻度,量筒、滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 向3支试管中各加入2mL 0.1mol•L-1酸性高锰酸钾溶液和2mL 0.01mol•L-1 H2C2O4溶液,将它们分别置于冰水、室温下、80℃热水中,观察比较褪色快慢 | |
| C. | 皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬脂酸钠 | |
| D. | 为保证实验安全,金属钠切割下来的表层物质应放回原试剂瓶,不能在研钵中研磨氯酸钾或硝酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
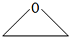 .
.
 ;
;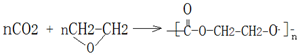 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com