
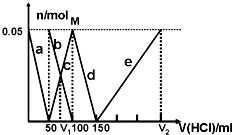
 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )| A、原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| B、V1:V2=1:4 |
| C、M点时生成的CO2为0mol |
| D、a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)3↓ |
| 0.15mol |
| 1mol/L |


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
| 元素 | 相 关 信 息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z是地壳中含量最高的金属元素 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/mol?L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
A、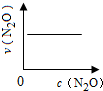 |
B、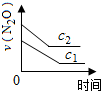 |
C、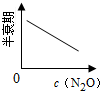 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.24 mol |
| B、0.21 mol |
| C、0.25 mol |
| D、0.14 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
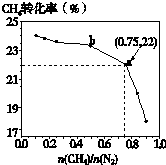 已知:3CH4(g)+2N2(g)
已知:3CH4(g)+2N2(g)| 700℃ |
| 催化剂 |
| n(CH4) |
| n(N2) |
A、
| ||
B、
| ||
| C、b点对应的平衡常数比a点的大 | ||
| D、a点对应的NH3的体积分数约为26% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可能是Al3+,也可能是Mg2+ |
| B、只能是Al3+ |
| C、只能是Mg2+ |
| D、以上说法都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com