
用1 L 0.1 mol·L-1NaOH溶液吸收0.8 mol CO2所得溶液中![]() 和
和![]() 物质的量浓度之比约是( )
物质的量浓度之比约是( )
A.1∶3 B.2∶1 C.2∶3 D.3∶2
 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
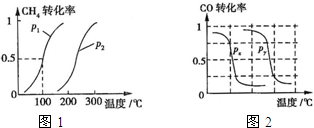 (2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.
(2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) | ||
| l | 150 |
|
0.1 | ||
| 2 | n |
|
5 | ||
| 3 | 350 | m | 5 |
| 1 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 1 |
| 2 |
| △H2+△H2-△H3 |
| 3 |
| △H2+△H2-△H3 |
| 3 |
| c(H2O) |
| c(H2) |
| c(H2O) |
| c(H2) |
| 实验 编号 |
催化剂 | 反应时间和m(O2)/g | |||||
| 10s | 20s | 30s | 40s | 50s | 60s | ||
| 1 | α-Fe2O3 | 0.055 | 0.215 | 0.290 | 0.310 | 0.320 | 0.320 |
| 2 | γ-Fe2O3 | 0.053 | 0.220 | 0.291 | 0.310 | 0.320 | 0.320 |
| 3 | MnO2 | 0.065 | 0.270 | 0.300 | 0.320 | 0.320 | 0.320 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 按要求完成下列小题.
按要求完成下列小题.| 3m |
| 112V |
| 3m |
| 112V |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
Ⅰ.(1)④、⑤、⑥的原子半径由大到小的顺序为 。
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)由表中两种元素的原子按11组成的常见液态化合物的稀液易被催化分解,其结构式为 ,它非常容易被一种日常常见过渡金属离子还原,在酸性条件的离子反应方程式为 。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
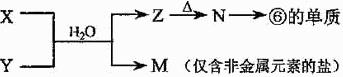
X溶液与Y溶液反应的离子方程式为 。常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 ;若Y与M混合则可使溶液呈碱性,此时溶液中离子浓度大小顺序为 。(填一种合理即可)
Ⅱ实验室制取③的氢化物的方程式为 ,已知该氢化物与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
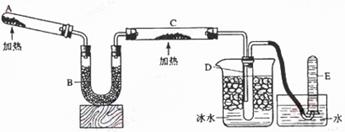
回答下列问题:
(1)B中加入的物质是 ,其作用是 。
(2)实验时在C中观察到得现象是 ,发生反应的化学方程式是 。
(3)D中收集到的物质是 ,检验该物质的方法和现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某自来水中含有Ca2+、Mg2+、Na+、K+、HCO3—、SO42—、Cl—,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据为

(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因: 。
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是 (填序号)。
A、食醋 B、氯化钡 C、碳酸钠 D碳酸氢钠
CaSO4能转化为物质Y 的原因是(用文字叙述)
。
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式) 。
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应。现取含Ca2+浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com