
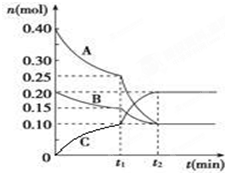
 现将0.4mol A气体和0.2mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量随时间的变化如图:
现将0.4mol A气体和0.2mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量随时间的变化如图:| △c |
| △t |
| △c |
| △t |
| ||
| 10min |


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
| A、将 0.1 mol?L-1HCl溶液加热到100℃,溶液的pH仍为1 |
| B、将pH=4的醋酸溶液加水稀释后,溶液中所有离子的浓度均降低 |
| C、若1mLpH=1的盐酸与10mLNaOH溶液混合后溶液的pH=7,则NaOH溶液的pH=12 |
| D、在滴有酚酞试液的氨水中,加入NH4Cl至溶液呈无色,此时溶液一定显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、pH=1的溶液中K+ CrO
| ||||||
B、饱和氯水中Cl- NO
| ||||||
C、能使pH试纸变红的溶液NH
| ||||||
D、FeCl2溶液中K+ Na+ SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
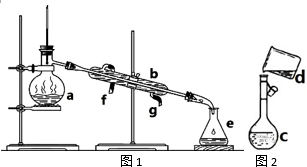 掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
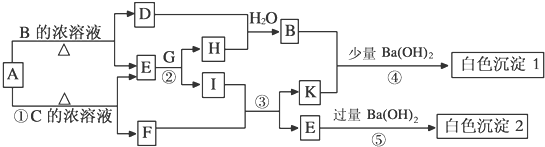
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com