
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为
A. mol/L B.
mol/L B.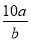 mol/L C.
mol/L C.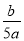 mol/L D.
mol/L D.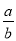 mol/L
mol/L
科目:高中化学 来源:2014-2015学年湖南省高一上学期第一次阶段考试化学试卷(解析版) 题型:选择题
下列化学实验操作或事故处理方法不正确的是 ( )
A.碱沾到皮肤上时,应立即用大量水冲洗,再涂上硼酸溶液
B.浓硫酸沾到皮肤上时,可立即用大量水冲洗,然后涂上3%~5%的NaHCO3溶液
C.酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭,不能用水泼灭
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高二上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_______________ ____,
②同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是_________ ________,
③当其c(H+)相同时,物质的量浓度由大到小的顺序为________________ _____,
④当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序为__________________ ___。
⑤当pH相同、体积相同时,同时加入锌,若产生相同体积的氢气(相同状况)则开始时反应速率__________________,反应所需的时间__________ _____ ____。
⑥将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为_____________ _______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关叙述中正确的是:( )
A.难溶于水的电解质一定是弱电解质
B.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强
C.易溶于水的电解质一定是强电解质
D.强电解质在水溶液中的电离过程是不可逆的
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
V mL Al2(SO4)3溶液中含Al3+a g,取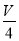 mL溶液稀释到4 V mL,则稀释后溶液中SO
mL溶液稀释到4 V mL,则稀释后溶液中SO 的物质的量浓度是( )
的物质的量浓度是( )
A. 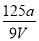 mol·L-1 B.
mol·L-1 B. mol·L-1 C.
mol·L-1 C. mol·L-1 D.
mol·L-1 D. mol·L
mol·L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
两份质量相同的CH4和NH3相比较,下列结论错误的是
A.分子个数比为17:16 B.原子个数比为17:16
C.氢原子个数比为17:12 D.氢原子质量比为 17:12
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在标准状况下,11.2 L某气体的质量为22 g,则该气体的相对分子质量是44 g/mol
B.16 g O2和16 g O3含的氧原子个数一样多
C.在标准状况下,水、氧气和氮气分子间的平均距离都相等
D.1 mol氯化钙溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高二上期中考试化学试卷(解析版) 题型:选择题
在CH3COOH  CH3COO- + H+ 的电离平衡中,要使电离平衡右移,且氢离子浓度增大,应采取的措施是
CH3COO- + H+ 的电离平衡中,要使电离平衡右移,且氢离子浓度增大,应采取的措施是
A.加NaOH(s) B.加浓盐酸 C.加水 D.加热
查看答案和解析>>
科目:高中化学 来源:2014-2015学年贵州省高二上学期半期考试化学试卷(解析版) 题型:填空题
(16分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应的正反应是____反应(填“放热”或“吸热”),该反应的平衡常数表达式为 。
(2)能判断该反应是否达到化学平衡状态的依据是 (填序号)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)在实际生产中,该反应的适宜条件为 .
A.加压,400~500℃ 催化剂 B.加压,830~1000℃ 催化剂
C.常压,400~500℃ 催化剂 D.常压,830~1000℃ 催化剂
(4)在830 ℃时,2L的密闭容器中加入4molCO(g)和6molH2O(g),10 min后达到平衡时,CO2的平衡浓度为___________,用H2浓度变化来表示的平均反应速率为____________, CO的转化率是_________。
(5)为使该反应的反应速率增大且平衡向正反应方向移动的是___________(填字母序号).
a.增大CO浓度 b.升高温度
c.将生成物分离出去 d.使用高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com