
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
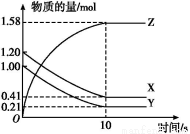
(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:
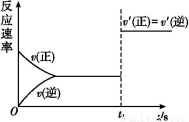
则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
(1)0.079 mol·L-1·s-1 0.395 mol·L-1 79.0%
(2)X(g)+Y(g) 2Z(g)
2Z(g)
(3)CD
【解析】(1)分析图像知:
v(Z)= 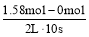 =0.079 mol·L-1·s-1,
=0.079 mol·L-1·s-1,
Δc(X)=  =0.395 mol·L-1,
=0.395 mol·L-1,
Y的转化率α(Y)=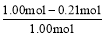 ×100%=79%。
×100%=79%。
(2)由各物质转化的量:X为0.79 mol,Y为0.79 mol,Z为1.58 mol可知方程式中各物质的化学计量数之比为1∶1∶2,则化学方程式为X(g)+Y(g) 2Z(g)。
2Z(g)。
(3)由图像可知,外界条件同等程度地增大了该反应的正、逆反应速率。增大X的浓度、升高体系温度均不会同等程度地改变正、逆反应速率,A、B错误。该反应为反应前后气体体积不变的反应,缩小容器体积或增大压强,均可同等程度地增大正、逆反应速率,C正确。D使用催化剂可同等程度地改变正、逆反应速率,D正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学名师综合题专练 物质性质综合应用练习卷(解析版) 题型:填空题
某工业废渣的主要成分为SiO2、Fe2O3、Al2O3、MgO。现根据下列方案对其进行处理以回收废渣中的金属元素。
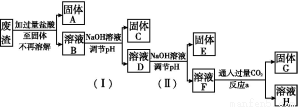
回答下列问题。
(1)固体A的化学式为 。
(2)反应a的化学反应方程式为 。
(3)25 ℃时,溶液中金属离子的物质的量浓度与溶液pH的关系如图所示:
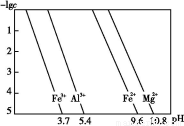
①调节pH(Ⅰ)的pH为 ;
②溶液D加入氢氧化钠溶液的同时调节pH(Ⅱ)所发生反应的离子方程式为 ;
③从图中数据计算可得Mg(OH)2的溶度积Ksp[Mg(OH)2]约为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修2化学与技术练习卷(解析版) 题型:填空题
锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下:
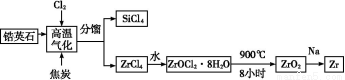
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO): ;
(2)写出ZrOCl2·8H2O在900 ℃生成ZrO2的反应方程式 ;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (单选)。
A.二氧化锆纳米陶瓷是新型无机非金属材料
B.1纳米=10-10米
C.锆合金的硬度比纯锆要高
D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题9溶液中的电离平衡练习卷(解析版) 题型:选择题
将0.1 mol·L-1的氨水加水稀释至0.01 mol·L-1,稀释过程中温度不变,下列叙述正确的是( )
A.稀释后溶液中c(H+)和c(OH-)均减小
B.稀释后溶液中c(OH-)变为稀释前的1/10
C.稀释过程中氨水的电离平衡向左移动
D.稀释过程中溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题8化学反应速率与化学平衡练习卷(解析版) 题型:选择题
用来表示可逆反应:2A(g)+B(g) 2C(g) ΔH<0 的正确图像是下图中的( )
2C(g) ΔH<0 的正确图像是下图中的( )
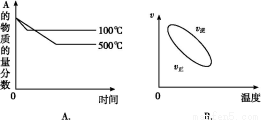
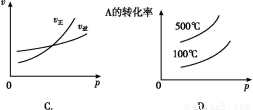
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题7元素周期表与元素周期律练习卷(解析版) 题型:选择题
X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
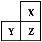
A.原子半径:Y>Z>X
B.气态氢化物的热稳定性:X<Z
C.Y和Z的最高价氧化物对应水化物均为强酸
D.若Z的最高正价为+m,则X的最高正价也一定为+m
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题7元素周期表与元素周期律练习卷(解析版) 题型:选择题
下列有关物质的性质或结构的说法正确的是( )
A.L层上的电子数为奇数的原子一定是主族元素的原子
B.周期表中的碱金属元素从上到下,其单质的还原性逐渐增强,熔沸点逐渐升高
C.化学键的形成一定伴随着电子的转移和能量变化
D.同主族元素从上到下,单质的熔点逐渐降低
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题5化学能与热能练习卷(解析版) 题型:选择题
在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )
A.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1
NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1
B.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1
NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1
C.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1
NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1
D.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1
NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题2化学计量及其应用练习卷(解析版) 题型:选择题
36.5 g HCl溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,NA表示阿伏加德罗常数的值,则下列叙述中正确的是( )
A.所得溶液的物质的量浓度为1 mol/L
B.所得溶液中含有NA个HCl分子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数:w=36.5c/(1 000ρ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com