
【题目】PSCl3 、S2Cl2、SOCl2等含硫化合物用途非常广泛。
(1)PSCl3(结构式为: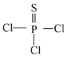 )中磷的化合价为______。
)中磷的化合价为______。
(2)S2Cl2分子中各原子均满足8电子结构,画出S2Cl2的结构式:_____。
(3)能说明同周期的相邻元素S的非金属性比Cl弱的事实是_____(填标号)。
A.H2SO3的酸性比HClO3的弱
B.气态H2S的热稳定性比HCl的弱
C.Cl2通入Na2S溶液可发生反应:Cl2+S2-=2Cl-+S↓
D.SO2是常见的还原剂,ClO2是常见的氧化剂
(4)SOCl2(沸点78.8℃)可用作锂电池的非水电解质及有机合成的氯化剂等。
①SOCl2可由S2Cl2、SO2及Cl2在催化剂和180~200℃时,通过发生化合反应制得,该反应的化学方程式为_____。
②Li/SOCl2电池的电池反应为:4Li+2SOCl2→4LiCl↓+S+SO2。电池工作时,下列说法正确的是____(填标号)。
A.Li电极的质量不变 B.电能转变为化学能
C.负极发生氧化反应 D.正极上SOCl2被还原
【答案】+5 Cl-S-S-Cl BC S2Cl2+2SO2+3Cl2![]() 4SOCl2 CD
4SOCl2 CD
【解析】
(1)PSCl3中,结合结构式( )可知硫为-2价,氯为-1价,则磷的化合价为+5价;
)可知硫为-2价,氯为-1价,则磷的化合价为+5价;
(2)S2Cl2分子中各原子均满足8电子结构,故S2Cl2的结构式为Cl-S-S-Cl;
(3)A.通过含氧酸的酸性强弱来判断元素的非金属性强弱,一定要注意是用最高价的含氧酸,H2SO3和HClO3均不是最高价含氧酸,选项A错误;
B.元素的非金属性越强,对应氢化物就越稳定,气态H2S的热稳定性比HCl的弱,故Cl比S的非金属性强,选项B正确;
C.Cl2通入Na2S溶液可发生反应:Cl2+S2-=2Cl-+S↓,说明氯气的氧化性强于硫,非金属单质氧化性越强,元素非金属性越强,选项C正确;
D.SO2、ClO2均不是最高价氧化物,不能根据它们的氧化性、还原性判断它们的非金属性强弱,选项D错误。
答案选BC;
(4)①SOCl2可由S2Cl2、SO2及Cl2在催化剂和180~200℃时,通过发生化合反应制得,反应的化学方程式为S2Cl2+2SO2+3Cl2![]() 4SOCl2;
4SOCl2;
②A.Li电极上生成LiCl,质量增加,选项A错误;
B.原电池是将化学能转为电能的装置,选项B错误;
C.原电池中负极发生失电子的氧化反应,选项C正确;
D.正极上SOCl2得电子被还原,选项D正确。
答案选CD。


科目:高中化学 来源: 题型:
【题目】Ⅰ.下列各组粒子,属于同种核素的是___________(填编号,下同),互为同位素的是___________,互为同素异形体的是___________,互为同分异构体的是___________,属于同种物质的是_____________,互为同系物的是__________。
①16O2和18O3 ② CH4 和C3H8 ③ H、D、T④ 3015R和 (核内15个中子)⑤CH3CH2OH和CH3OCH3⑥
(核内15个中子)⑤CH3CH2OH和CH3OCH3⑥ 和
和
Ⅱ.能源是现代社会发展的支柱之一。
⑴化学反应中的能量变化,主要表现为热量的变化。
①下列反应中,属于放热反应的是_________(填字母)。
A.Ba(OH)2·8H2O与NH4Cl混合搅拌 B.高温煅烧石灰石
C.铝与盐酸反应 D.C+H2O(g)=CO+ H2
②拆开1mol H﹣H键,1mol N﹣H键,1mol N≡N键分别需要吸收的能量
为a kJ,b kJ,c kJ,则1molN2和H2完全反应生成2mol NH3需要放出的热量为____________kJ。
⑵电能是现代社会应用最广泛的能源之一。

如下图所示的原电池装置中,负极是_______,正极上能够观察到的现象是_______________________,正极的电极反应式是_____________________。原电池工作一段时间后,若消耗锌6.5 g,则放出气体________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气、水体污染的治理是化学工作者研究的重要课题,燃煤的烟道气和汽车尾气是造成雾霾天气污染的原因之一。
(1)用CH4催化还原氮氧化物,已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1= a kJ/mol,欲计算反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(1)的焓变△H2,则还需要查找某化合反应的焓变△H3,该化合反应中各物质化学计量数之比为最简整数比时△H3=bkJ/mol,则该化合反应的热化学方程式为____________________。据此计算出△H2=__________kJ/mol(用含a和b的式子表示)。
(2)汽车尾气转化的反应之一:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H=-746.5kJ/mol。在某温度时,可按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表:
N2(g)+2CO2(g) △H=-746.5kJ/mol。在某温度时,可按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率υ(N2)=______________________________。
②在该温度下,反应的平衡常数K=___________(只写出计算结果)。
③对于该可逆反应,通过综合分析以上信息,至少可以说明___________(填字母)。
A.该反应的反应物混合后很不稳定
B.在催化剂的作用下,该反应一旦发生将在较短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)通过调节溶液pH,在弱碱性条件下,用漂白粉溶液可将废水中的CN-转化为碳酸盐和N2而除去。写出该反应的离子方程式为______________________。
(4)废水中的重金属离子通常用沉淀法除去。已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,国家规定的排放标淮:镍低于1.1×10-5mol·L-1,铜低于7.8×10-5mol·L-l。则需要控制溶液中S2-的浓度不低于__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在紫外线的作用下,氧气可生成臭氧:3O2![]() 2O3,一定条件下该反应达到平衡状态的标志是( )
2O3,一定条件下该反应达到平衡状态的标志是( )
A. 单位时间内生成2 mol O3,同时消耗3 mol O2
B. O2的消耗速率0.3 mol·L-1·s-1,O3的消耗速率0.2 mol·L-1·s-1
C. 容器内,2种气体O3、O2浓度相等
D. 气体密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaN3是一种易溶于水(NaN3=Na++N3-)的白色固体,可用于有机合成和汽车安全气囊的产气药等。钠法(液氨法)制备NaN3的工艺流程如下:

(1)钠元素位于周期表第______周期______族。
(2)NaNH2中氮元素的化合价为_______;Na+的结构示意图为_____。
(3)NaOH的电子式为______。
(4)反应NH4NO3![]() N2O↑+2H2O↑中,每生成1molN2O转移电子数为_____个。
N2O↑+2H2O↑中,每生成1molN2O转移电子数为_____个。
(5)反应①的化学方程式为______。
(6)销毁NaN3可用NaClO溶液,该销毁反应的离子方程式为______(N3-被氧化为N2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如图所示的变化。

试回答:
(1)写出符合下述条件A的同分异构体的结构简式(各任写一种即可):
a.具有酸性________;b.能发生水解反应_________。
(2)A分子中的官能团是______,D的结构简式是__________。
(3)C→D的反应类型是_____,E→F的反应类型是_________。
A.氧化反应 B.还原反应 C.加成反应 D.取代反应
(4)写出化学方程式:A→B____________________。
(5)写出E生成高聚物的化学方程式:_______________。
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CrO42-+2H+![]() Cr2O72-+H2O。25℃时,调节初始浓度为1.0 molL-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法正确的是
Cr2O72-+H2O。25℃时,调节初始浓度为1.0 molL-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法正确的是

A. 平衡时,pH越小,c(Cr2O72-)越小
B. A点CrO42-转化为Cr2O72-反应的平衡常数的数量级为1014
C. C点CrO42-的平衡转化率为40%
D. 平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(用元素符号或化学式回答下列问题)
(1)在这些元素中,化学性质最不活泼的是_______,其原子结构示意图是_________。
(2)用电子式表示元素④与⑦组成的化合物的形成过程:________,该化合物属于_______(填“共价”或“离子”)化合物。
(3)常温下呈液态的非金属单质是_______。
(4)表中能形成两性氢氧化物的元素是_________,该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式是___________。
(5)①、⑥、⑦三种元素的最高价氧化物对应的水化物中,按酸性增强的顺序排列为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com