
【题目】化学变化中的能量转换对于生产具有重大意义和研究价值。回答下列问题:
(l)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。

①过程Ⅰ能量__(填“释放”或“吸收”。
②已知:CO2(g)+H2(g)═CO(g)+H2O(g) △H═+41kJmol-1:
2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H═-128kJmol-1:
3CO2(g)+9H2(g)═C3H6(g)+6H2O(g) △H═+157.5kJmol-l
C2H4(g)+C3H6(g)+H2(g)═C5H12(异戊烷,g) △H=+267.6kJmol-1。
则5CO(g)+11H2(g)═C5H12(异戊烷,g)+5H2O(g)△H=__kJmol-1。
(2)一种铜版画雕刻用的酸性蚀刻液的有效成份是CuCl2,蚀刻反应为:Cu2++Cu+6Cl-═2CuCl32-。工业上用电解法将CuCl32-转化为Cu2+,使蚀刻液再生并回收金属Cu。装置如图(电极不参与反应)。

①再生的CuCl2蚀刻液为流出液__(填“a”或“b”)。
②写出N极的电极反应:__。
③装置中使用___离子交换膜(填“阳”或“阴”)。若电解池工作前,阴极室和阳极室中电解液质量相等,当转移0.1mol电子,流出液未流出时,两侧电解液的质量差为__g。
【答案】吸收 +92.1 a Cu2++2e-═Cu 阴 10.3
【解析】
(1)①断开化学键要吸收热量,形成化学键要放出热量;
②已知:CO2(g)+H2(g)═CO(g)+H2O(g)△H1= +41kJmol-1;
2CO2(g)+6H2(g)═C2H4(g)+4H2O(g)△H2= -128 kJmol-1;
3CO2(g)+9H2(g)═C3H6(g)+6H2O(g)△H3= +157.5kJmol-l ;
C2H4(g)+C3H6(g)+H2(g)═C5H12(异戊烷,g)△H4= +267.6kJmol-1;
则5CO(g)+11H2(g)═C5H12(异戊烷,g)+5H2O(g)△H,由盖斯定律可知,△H=-5①+②+③+④;
(2)蚀刻过程中将Cu转化为CuCl32-去除,涉及反应为Cu与Cu2+反应可生成CuCl,CuCl与Cl-生成CuCl32-,涉及反应为Cu2++Cu+2Cl-═2CuCl、CuCl+2Cl-CuCl32-,工业上用电解法将CuCl32-转化为Cu2+,使蚀刻液再生并回收金属Cu的原理分析如下:阳极M发生氧化反应,将CuCl32-转化为Cu2+,则阳极发生反应:CuCl32--e-═Cu2++3Cl-,阳极区的Cu2+进入阴极区b,要回收得到金属Cu,就由Cu2+发生还原反应生成,就在阴极N生成,回收得到金属Cu.阴极区的Cl-通过阴离子交换膜进入阳极区a,使蚀刻废液CuCl32-再生,据此答题。
①蚀刻废液CuCl32-再生,可使CuCl32-发生氧化反应得到Cu2+;
②连着电源负极为阴极,应由Cu2+发生还原反应生成,回收得到金属Cu;
③阴极区的Cl-通过阴离子交换膜进入阳极区a,使蚀刻废液CuCl32-再生,根据得失电子守恒计算。
(1)①过程Ⅰ是CO2(g)转变成CO(g)和O的过程,断开化学键要吸收能量;
②已知:①CO2(g)+H2(g)═CO(g)+H2O(g)△H1═+41kJmol-1,②2CO2(g)+6H2(g)═C2H4(g)+4H2O(g)△H2═-128 kJmol-1,③3CO2(g)+9H2(g)═C3H6(g)+6H2O(g)△H3═+157.5kJmol-l ,④C2H4(g)+C3H6(g)+H2(g)═C5H12(异戊烷,g)△H4=+267.6kJmol-1。 则5CO(g)+11H2(g)═C5H12(异戊烷,g)+5H2O(g)△H,由盖斯定律可知,△H=-5①+②+③+④=-5×41kJmol-1+(-128 kJmol-1)+157.5kJmol-l+267.6kJmol-1=+92.1kJmol-1;
(2)①从题给的信息来看,工业上CuCl2和盐酸的混合液作为蚀刻液,电解的过程,将CuCl32-转化为Cu2+,发生了氧化反应,应该在阳极M发生: CuCl32--e-═Cu2++3Cl-,阴极区的Cl-通过阴离子交换膜进入阳极区a,使蚀刻废液CuCl32-再生;
②电解的过程,阳极区的Cu2+进入阴极区b,Cu2+发生还原反应生成,就在阴极N生成,回收得到金属Cu,N极的电极反应:Cu2++2e-═Cu;
③从题给的信息来看,阳极M发生:CuCl32--e-═Cu2++3Cl-,阴极的电极反应:Cu2++2e-═Cu,阴极区的Cl-要通过阴离子交换膜进入阳极区,中和电荷,使蚀刻废液CuCl32-再生,若电解池工作前,阴极室和阳极室中电解液质量相等,当转移0.1mol子,流出液未流出时 阳极M发生:CuCl32--e-═Cu2++3Cl-,转移1mol电子时,从原来的带两个负电,变为一个负电,故阴极区的Cl-要通过阴离子交换膜进入阳极区, 阴极的电极反应:Cu2++2e-═Cu,当转移2mol电子时,从溶液中要析出1mo铜,还要有2molCl-要通过阴离子交换膜进入阳极区,所以当转移2mol电子,流出液未流出时,两侧电解液的质量差为1mo铜和4molCl,

![]() ,m=10.3g。
,m=10.3g。


科目:高中化学 来源: 题型:
【题目】四元轴烯t,苯乙烯b及立方烷c的结构简式如下,下列说法正确的是
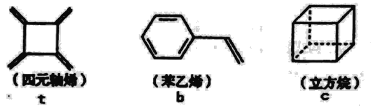
A.b的同分异构体只有t和c两种B.t和b能使酸性KMnO4溶液褪色而c不能
C.t、b、c的二氯代物均只有三种D.b中所有原子-定不在同-个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室进行实验验证,他们设计组装了如下图所示装置,已知a为石墨电极;b为铁电极;c为铝电极(已除去表面氧化膜);d为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好导线后,电流计指针发生明显偏转。下列判断正确的是
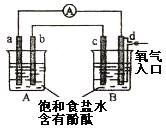
A.b为负极,d为阳极
B.一段时间后,a和d电极附近溶液变红
C.b电极电极反应式为:2Cl-—2e-=Cl2↑
D.当电解一段时间,B中出现大量白色沉淀时,停止实验,再将A中溶液倒入B中混合,充分振荡,沉淀全部消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molX和0.8molY置于体积为2L的恒容密闭容器中,发生反应:2X(g)+Y(s)![]() M(g)+N(g) △H。反应过程中测得N的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
M(g)+N(g) △H。反应过程中测得N的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
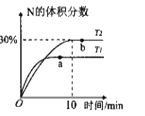
A.无论温度为T1还是T2,当容器中气体密度不变或压强不变时,反应达平衡状态
B.温度为T2时,X的平衡转化率为60%,平衡常数K=5.625
C.T1、T2的平衡常数分别为K1、K2,则K1<K2
D.降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 M、N 是合成某功能高分子材料的中间产物,下列关于 M、N 说法正确的是
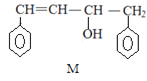
![]()
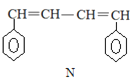
A.M、N 都属于芳香烃,但既不是同系物,也不是同分异构体
B.M、N 分别与液溴混合,均发生取代反应
C.M、N 均能使酸性高锰酸钾溶液褪色
D.M、N 分子所有原子均可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子核外电子的描述正确的是
A.s 能级的能量总小于 p 能级的能量
B.2s 的电子云半径比 1s 电子云半径大,说明 2s 的电子比 1s 的多
C.基态铜原子的价电子轨道表示式为 ![]()
D.nf 能级中最多可容纳 14 个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾在饮用水源和废水处理过程中,不仅能去除污染物和致癌化学污染物,而且不产生任何诱变致癌的产物,具有高度的安全性;其可溶于水,微溶于浓 KOH 溶液,且在强碱性溶液中比 较稳定。实验室用次氯酸盐氧化法制备高铁酸钾(K2FeO4)的流程如图所示:
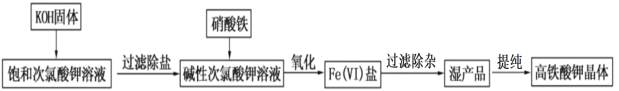
流程图中的饱和次氯酸钾溶液的制备装置如图所示:
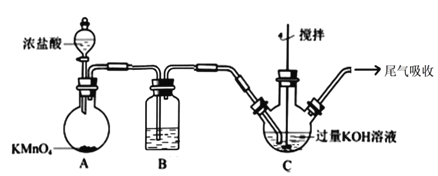
(1)A 为氯气发生装置。A 中反应的离子方程式是___________;装置 B 内的试剂及作用是____________;
(2)装置 C 反应温度控制在 0~5℃进行,在不改变 KOH 溶液浓度前提下,实验中可采取措施是________。
(3)流程图中在加入 KOH 固体的时候会产生大量的白色沉淀_____(填化学式)。
(4)在搅拌下,将 Fe(NO3)3饱和溶液缓慢滴加到 KClO 饱和溶液中即可制取 K2FeO4,写出该反应的离子方程式__________;反应过程中温度控制在 10~15℃,温度过低或过高对反应的影响是_____________。
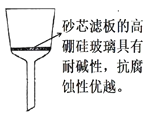
(5)过滤除杂时不用普通漏斗和滤纸而采用砂芯漏斗(如图)的原因是_____________。
(6)在提纯高铁酸钾时采用重结晶、洗涤、干燥的方法,洗涤剂可以选用_____。
A.H2O B.浓 KOH 溶液 C.Fe(NO3)3溶液 D.异丙醇
(7)若提纯得到 a gK2FeO4(M=198g/mol),上述流程中有 5%的 Fe 损失,则需要提供 Fe(NO3)3(M=242g/mol)的质量为_____g(用含 a 的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.C60 和 C70互为同位素
B.N2 、N3- 、N4、N5+互为同素异形体
C.立方烷(![]() )和苯乙烯互为同分异构体
)和苯乙烯互为同分异构体
D.CH3CH2COOH 和HCOOCH2CH2CH3 互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为测定化合物Co(NH3)yClx(其中Co为+3价)的组成,进行如下实验。
(1)氯的测定:准确称取2.675g该化合物,配成溶液后用1.00mol·L-1AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀(Ag2CrO4为砖红色)且不再消失时,消耗AgNO3溶液30.00mL。[已知:Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.12×10-12]
①AgNO3标准溶液需要放在棕色的滴定管中的原因是__。(用化学方程式表示)
②若滴定终点读数时滴定管下口悬挂了一滴液体,会使得测定结果__。(填“偏大”、“偏小”、“无影响”)
③用K2CrO4溶液作指示剂的理由是__。
(2)氨的测定:再准确称取2.675g该化合物,加适量水溶解,注入如图4___。(填仪器名称)中,然后通过仪器3滴加足量的NaOH溶液,加热1装置,产生的氨气被5中的盐酸吸收,多余的盐酸再用NaOH标准溶液反滴定,经计算,吸收氨气消耗1.00mol·L-1盐酸60.00mL。

装置A在整个实验中的作用是__,如果没有6中的冰盐水,会使得测定结果___(填“偏大”、“偏小”、“无影响”)。
(3)通过处理实验数据可知该化合物的组成为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com