
【题目】下列关于金属矿物质开发的叙述正确的是( )
A. 从金属矿物中获得金属是金属元素被氧化的过程
B. 从HgO中获得金属Hg可以直接用加热分解的方法
C. 从NaCl中获得金属Na可用还原剂还原
D. 从Fe2O3中获得金属Fe,工业上常用电解法
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3
A.③④B.①②③④C.①③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的核外电子排布式为___________,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________,与其为等电子体的分子是___________
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
(3)单质铜及镍都是由____键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol–1,ICu> INi的原因是______________________。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为____________。
②若合金的密度为d g·cm–3,晶胞参数a=__________nm。
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+ 配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3和NH3键角不同,其中键角较大的是____________,其原因是_______________________。且NF3不易与Cu2+形成配离子,其原因是:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始容积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断不正确的是

A. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
B. 该反应的化学方程式为3Z ![]() 3X+2Y
3X+2Y
C. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
D. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 Ca(OH)2 与 Cl2 反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应。生成 Cl-、ClO-、ClO3- 三种含氯元素的离子,其中 ClO- 、ClO3- 两种离子的物质的量(n)与反应时间
(t)的曲线如图所示。

(1)t1 时,开始有 ClO3-生成的原因是_____。
(2)t2 时,Ca(OH)2 与 Cl2 发生反应的总的化学方程式为___________。
(3)该石灰乳中含有 Ca(OH)2 的物质的量是________mol。
(4)若反应物的量不变,在某温度下恰好完全反应时,氧化产物比值为![]() a ,则 n(Cl-)=_____mol
a ,则 n(Cl-)=_____mol
(用含 a 的代数式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如下图,关于该有机物的空间构型下列说法中正确的是( )
![]()
A. 该分子中一定共面的碳原子数至少为8个
B. 该分子中所有的碳原子均可能处于同一平面上
C. 该分子中至少有9个碳原子处于同一条直线上
D. 该分子中处于同一平面的的原子总数最多为16个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和M在周期表中的位置如图所示,Y原子序数是X的2倍。下列说法不正确的是
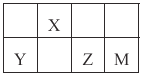
A. Z、M、X的简单离子半径依次减小
B. Y和M可形成离子化合物YM4
C. X的简单气态氢化物的稳定性强于Y的
D. M的最高价氧化物对应水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列各实验装置的叙述中,不正确的是
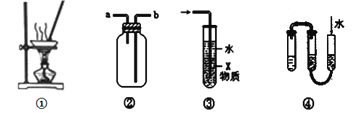
A. 装置①可用蒸发操作,蒸干FeSO4溶液获取FeSO4·7H2O晶体
B. 装置②可用于收集H2、Cl2、SO2、NO2等气体
C. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D. 装置④所示方法可检查该装置的气密性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液逐滴加入0.2mol·L1的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是( )

A. 原NaOH溶液的浓度为0.1mol·L1
B. 通入CO2的体积为448mL
C. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=2∶1
D. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com