
将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
A.Mg和Al的总质量为8 g
B.硫酸的物质的量浓度为5 mol·L-1
C.NaOH溶液的物质的量浓度为5 mol·L-1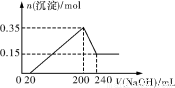
D.生成的H2在标准状况下的体积为11.2 L
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源:2015-2016学年辽宁省高二上12月月考化学试卷(解析版) 题型:选择题
下列有机知识正确的有_____个
①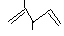 名称:2,3—二甲基—1,5—戊二烯 ②乙烯的实验式;CH2
名称:2,3—二甲基—1,5—戊二烯 ②乙烯的实验式;CH2
③用质谱仪和红外光谱均可以获得有机物所含化学键或官能团信息
④乙醇的分子式:C2H5OH ⑤苯乙炔共线的原子最多有6个
⑥对甲基苯甲醇的结构简式: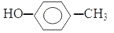
A. 2个 B.3个 C. 4个 D. 5个
查看答案和解析>>
科目:高中化学 来源:2016届广西河池市高三上第五次月考理综化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
B | 在KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变成蓝色 | KIO3的氧化性比I2强 |
C | 向CH2=CHCH2OH中滴入酸性高锰酸钾溶液 | 紫红色褪去 | 证明CH2=CHCH2OH中含有碳碳双键 |
D | 向Na2S溶液中加入酚酞,再滴加稀盐酸 | 溶液先变红,后红色变浅直至消失 | 证明非金属性:Cl>S |
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列溶液中氯离子的物质的量浓度与50mL 1mol•L-1氯化铝溶液中氯离子的物质的量浓度相等的是
A.150mL 1mol•L-1氯化钠溶液
B.75mL 1.5mol•L-1氯化钙溶液
C.150mL 3mol•L-1氯酸钾溶液
D.50mL 1mol•L-1氯化镁溶液
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上月考化学试卷(解析版) 题型:选择题
下列反应中,改变反应物的用量或浓度,不会改变生成物的是( )
A.铜和硝酸反应
B.二氧化碳通入氢氧化钠溶液中
C.细铁丝在氯气中燃烧
D.氯化铝与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省普宁市高一上学期第三次月考化学试卷(解析版) 题型:填空题
已知实验室制取C12的反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成C12;
MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成C12;
(1)写出PbO2与浓盐酸反应的化学方程式 ,其中表现还原性的HCl与表现酸性的HCl的物质的量之比为 。
(2)PbO2不稳定,随温度升高按下列顺序逐步分【解析】
PbO2→Pb2O3→Pb3O4→PbO。若加热分解后所得到的固体全部为Pb3O4,现将a molPbO2加热分解,则加热过程中放出O2_____L(标准状况下);
(3)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4+2CH3COONH4= (CH3COO)2Pb+(NH4)2SO4。
①PbSO4与CH3COONH4能进行反应的原因是符合了复分解反应条件之一的生成了 ,现将Na2S溶液与醋酸铅溶液混合有沉淀生成,则其反应的离子方程式应为 。
②已知+2价Sn的化合物具有强还原性。等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中,溶液中存在的主要金属阳离子是 (填序号)。
A.Pb2+ B.Pb4+ C.Sn2+ D.Sn4+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:选择题
在相同温度时,100mL 0.01mol·L-1 的醋酸溶液与10mL 0.1mol·L-1 的醋酸溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量 B.电离程度
C.H+的物质的量浓度 D.CH3COOH的物质的量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州市高一上学期期中测试化学试卷(解析版) 题型:选择题
下列表述正确的是
A.某离子第三层上和第二层上的电子数均为第一层的4倍
B.Cl-的结构示意图: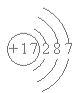
C.某物质的焰色反应为黄色,某物质一定为钠的化合物
D.14C和14N的质量数相等,互称为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com