
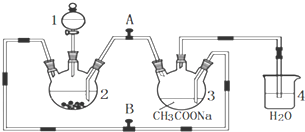
分析 (1)根据仪器结构特征,可知仪器1为分液漏斗;
(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出;
(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合;
(4)过量的锌与CrCl3充分反应得到CrCl2;
(5)CrCl3为0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,根据CrCl2计算[Cr(CH3COO)2]2•2H2O 的理论产量,进而计算其产率.
解答 解:(1)根据仪器结构特征,可知仪器1为分液漏斗,
故答案为:分液漏斗;
(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化,故先加盐酸一段时间后再加三氯化铬溶液,
故答案为:C;让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化;
(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合,应关闭阀门B,打开阀门A,
故答案为:B;A;
(4)锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是:过量的锌与CrCl3充分反应得到CrCl2,
故答案为:使锌与CrCl3充分反应得到CrCl2;
(5)CrCl3为$\frac{9.51g}{158.5g/mol}$=0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)可知CH3COONa足量,则得到[Cr(CH3COO)2]2•2H2O为0.06mol×$\frac{1}{2}$×376g/mol=11.28g,
所得产品的产率为:$\frac{9.48g}{11.28g}$×100%=84.0%,
故答案为:84.0%.
点评 本题考查物质制备实验方案的设计,为高考常见题型,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等,注意对题目信息的应用,有利于培养学生分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g14CH4所含中子数目为12NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA | |
| C. | 常温常压下,1mol NaHCO3与足量稀硫酸反应,生成气体的体积大于22.4L | |
| D. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>Z,而离子半径:Z>Y>W | |
| B. | 化合物丙中只存在共价键 | |
| C. | 测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 | |
| D. | 甲沸点远高于乙,可能是甲分子存在氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
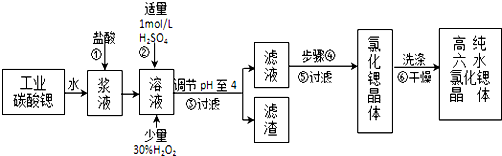
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
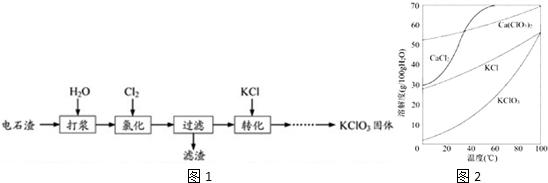
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
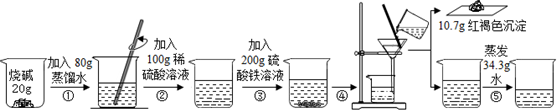
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com